
科目: 来源: 题型:选择题
| A | B | C | D | |
| 物质的 化学式 | NaOH(浓) | C2H5OH(酒精) | H2SO4 (浓) | NH4NO3 |
| 危险警 告标签 |  |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫酸铜有毒 | B. | 硫酸铜溶液是蓝色的胶体 | ||
| C. | 硫酸铜为电解质 | D. | 解毒的原因是Cu2+转化为沉淀 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
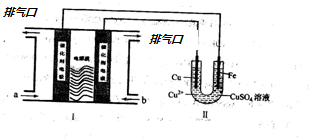
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目: 来源: 题型:选择题
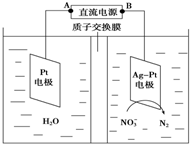
| A. | 铅蓄电池的B极为正极,电极材料为PbO2 | |
| B. | 铅蓄电池工作过程中负极质量增加 | |
| C. | 该电解池的阳极反应为:2 NO3-+6H2O-10e-═N2↑+12OH- | |
| D. | 若电解过程中转移10mol电子,则生成N2的体积为22.4L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 未加NaOH溶液时:c(H+)>c(Cl-)=c(CH3COOH) | |
| B. | 加入l0mLNaOH溶液时:c(CH3COO-)+c(OH-)=c(H+) | |
| C. | 加入20mLNaOH溶液时:c(Na+)=c(CH3COOH)+c(CH3COO一) | |
| D. | 加入20mLNaOH溶液时,酸碱恰好中和:c(OH-)=c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com