
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | CuS | ZnS | FeS | NiS | Al(OH)3 | Mg(OH)2 | Ni(OH)2 |
| pH | 3.2 | 9.7 | ≥-0.42 | ≥2.5 | ≥7 | ≥7.5 | ≥5 | ≥8 | ≥8.5 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验目的 | 实验操作 |
| A.证明Fe3+与SO2发生了氧化还原反应 | 将过量SO2通入FeCl3溶液中,然后将反应液加入酸性高锰酸钾溶液中,发现高锰酸钾溶液褪色. |
| B.除去CH3COOC2H5中的乙醇 | 加入适量CH3COOH,加热 |
| C.鉴别等浓度的Na2CO3溶液和NaHCO3溶液 | 分别向未知的溶液中滴加同浓度的盐酸,观察 现象 |
| D.比较H2CO3、HCN的酸性强弱 | 用pH计测定同温度同浓度的Na2CO3溶液和NaCN溶液 的pH值,比较pH大小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | E的单质不具有漂白能力 | |
| B. | A2D与DB2可发生氧化还原反应,氧化产物与还原产物的质量比为2:1 | |
| C. | A2D的还原性弱于AE的还原性 | |
| D. | B与C形成的两种离子化合物中,阴、阳离子个数比相等且所含化学键类型不完全相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
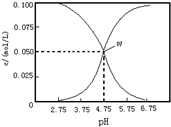
| A. | 该温度下醋酸的电离平衡常数为ka=10-4.75 | |
| B. | pH=6的溶液中,c(K+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol/L | |
| C. | pH=3.75的溶液中c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | 向W点所示溶液中通入0.1molHCl气体(溶液体积可以忽略不计)c(H+)=c(OH-)+c(CH3COOH) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使酚酞变红的溶液中,这些离子不可大量共存:Cl-,S2-,SO32-,K+ | |
| B. | 向CH3COOH溶液中滴加NaOH的过程中,计算式$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$的值始终不变 | |
| C. | 苯酚钠溶液中通入少量CO2,发生反应:2 +H2O+CO2→2 +H2O+CO2→2 +Na2CO3 +Na2CO3 | |
| D. | 硝酸亚铁溶液中滴入盐酸的离子反应方程式为:3Fe2++4H++NO3-═3Fe3++NO+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 过氧化钠常用于远途运输鱼苗的供氧 | |
| B. | 侯式制碱法的工艺过程中应用了物质的溶解性差异 | |
| C. | 加工后具有吸水性的植物纤维可用作食品干燥剂 | |
| D. | 使用含有钙离子浓度较大的地下水洗衣服,肥皂的去污能力减弱 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
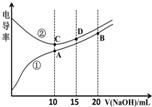 电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1 的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1 的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )| A. | 曲线①代表滴定HCl溶液的曲线 | |
| B. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1mol•L-1 | |
| C. | 在相同温度下,A、B、C三点溶液中水的电离程度:C<B<A | |
| D. | D点溶液中:c(Cl-)=2c(OH-)-2c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该混盐的水溶液呈碱性 | |
| B. | 该混盐溶液中加人BaCl2溶液,可以生成白色沉淀 | |
| C. | 该混盐与稀硫酸反应产生1mol S时转移2NA个电子 | |
| D. | 该混盐中的硫元素的化合价为-2和+4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com