
科目: 来源: 题型:选择题
| A. | 13 | B. | 14 | C. | 15 | D. | 不能确定 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | N2(g)+3H2(g)═2NH3(l)△H=2(a-b-c) kJ•mol-1 | |
| B. | N2(g)+3H2(g)═2NH3(g)△H=2(b-a) kJ•mol-1 | |
| C. | $\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(l)△H=2(b+c-a) kJ•mol-1 | |
| D. | $\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g)△H=2(a+b) kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属的电化学腐蚀比化学腐蚀更普遍 | |
| B. | 航海船船底四周镶嵌锌块保护船体,利用的是牺牲阳极保护法 | |
| C. | 用铝制铆钉连接铁板,铝钉易被腐蚀 | |
| D. | 原电池中电子由正扱流入负极 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 强电解质在水溶液中完全电离成阴、阳离子 | |
| B. | 在溶液中,导电能力强的电解质是强电解质 | |
| C. | 纯净的强电解质在液态时,有的导电,有的不导电 | |
| D. | 对同一弱电解质来说,当溶液的温度和浓度不同时,其导电能力也不相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2SO3溶液 | B. | NH4HCO3溶液 | C. | NaHCO3溶液 | D. | NaHSO3溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
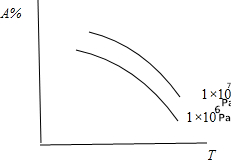
| A. | N2(气)+3H2(气)?2NH3(气);△H<0 | B. | C(固)+CO2(气)?2CO(气);△H>0 | ||
| C. | N2(气)十O2(气)?2N0(气);△H>0 | D. | CaCO3(固)?CaO(固)+CO2(气);△H>0 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向漂白液中通入少量CO2:2ClO-+CO2+H2O═2HClO+CO32- | |
| B. | 用氨水吸收足量二氧化硫:SO2+NH3•H2O═HSO3-+NH4+ | |
| C. | 用足量的氧氧化钠溶液吸收二氧化氮:3NO2+2OH-═2NO3-+NO+H2O | |
| D. | 次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
查看答案和解析>>
科目: 来源: 题型:解答题
| 反应阶段 | Ⅰ | Ⅱ | Ⅲ |
| 盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
| 现 象 | 无气体 | 产生气体 | 无气体 |
查看答案和解析>>
科目: 来源: 题型:解答题
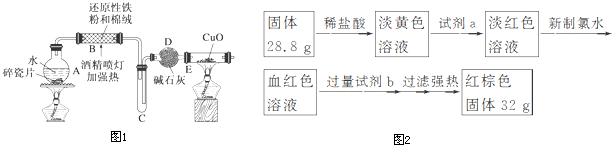
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com