
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 蔗糖的水解(试管、蔗糖溶液、新制的Cu(OH)2悬浊液) | |
| B. | 用NaOH标准溶液确定未知浓度的硫酸溶液(石蕊试液、碱式滴定管、锥形瓶) | |
| C. | 证明海带中存在碘元素(漏斗、稀硫酸、氯气、玻璃棒) | |
| D. | 制氢氧化铁胶体(饱和FeCl3溶液、NaOH溶液、胶头滴管) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2S的电子式:H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{S}}{••}$${\;}_{•}^{•}$]2-H+ | |
| B. | S2-的结构示意图: | |
| C. | Na2O2的电子式:Na+[$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$]2-Na+ | |
| D. | CCl4的电子式: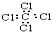 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
 已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍.现以A为主要原料合成F和高分子化合物E,其合成路线如图所示.
已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍.现以A为主要原料合成F和高分子化合物E,其合成路线如图所示.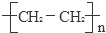 ,反应类型:加聚反应.
,反应类型:加聚反应.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | pH=3的醋酸溶液中:c(H+)=c(CH3COO-)=3.0mol•L-1 | |
| C. | 某溶液中由水电离出的c(OH-)=1×10-amol•L-1,若a>7时,则该溶液的pH可能为a | |
| D. | 常温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(NH4+ )>c(H+)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
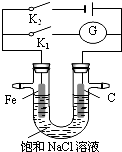
| A. | K1、K2闭合时,Na+均移向铁棒 | |
| B. | K1闭合,石墨棒周围溶液pH逐渐升高 | |
| C. | K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 | |
| D. | K2闭合,电路中通过0.4NA个电子时,两极共产生标况下4.48L气体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 医用酒精是指质量分数为75%的乙醇溶液 | |
| B. | 用过滤的方法可以分离乙酸乙酯和乙酸 | |
| C. | 葡萄糖、氨基酸在一定条件下都能发生酯化反应 | |
| D. | 在蛋白质溶液中加入浓的无机盐(如(NH4)2SO4、CuSO4等),可使蛋白质的溶解度降低而析出,这个过程称之为变性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 滴定管、移液管以及滴定过程中用于盛待测液的锥形瓶,使用前都需要洗涤与润洗 | |
| B. | 实验室制取氯气时,先装好二氧化锰,再检查装置的气密性 | |
| C. | 检验红色砖块中是否含三价铁的步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 | |
| D. | 在中和热测定的实验中,将氢氧化钠溶液和盐酸混合反应后的最高温度作为末温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com