
科目: 来源: 题型:选择题
| A. | 把aL0.1mol/L的CH3COOH溶液与bL0.1mol/L的KOH溶液混合,所得溶液中一定存在:c(K+)+c(H+)═c(CH3COO-)+c(OH-) | |
| B. | 把0.1mol/L的NaHCO3溶液与0.3mol/L的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c(OH-)>c(Ba+)>c(Na+)>c(H+) | |
| C. | 向1mol/L的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 | |
| D. | 常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同. |
查看答案和解析>>
科目: 来源: 题型:选择题
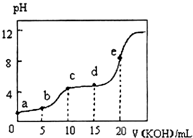 常温下,用0.10mol•L-1KOH溶液滴定10.00mL 0.10mol•L-1某二元弱酸H2R溶液,所得滴定曲线如图所示.下列叙述正确的是( )
常温下,用0.10mol•L-1KOH溶液滴定10.00mL 0.10mol•L-1某二元弱酸H2R溶液,所得滴定曲线如图所示.下列叙述正确的是( )| A. | a点所示溶液中:$\frac{c({H}^{+})}{c(O{H}^{-})}$<1012 | |
| B. | c点所示溶液中:c(K+)>c(HR-)>c(H2R)>c(R2-) | |
| C. | e点所示溶液中:c(H+)=c(HR-)+2c(H2R)+c(OH-) | |
| D. | 五个点中d点时c(HR-)最大 |
查看答案和解析>>
科目: 来源: 题型:解答题
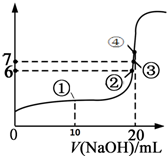 25℃时,向20mL 0.1mol/L的氢氟酸溶液中逐滴加入0.1mol/L NaOH溶液,滴加过程中混合溶液的pH变化曲线如图所示,回答下列问题:
25℃时,向20mL 0.1mol/L的氢氟酸溶液中逐滴加入0.1mol/L NaOH溶液,滴加过程中混合溶液的pH变化曲线如图所示,回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1mol•L-1NaHCO3溶液:H+、Al3+、Cl-、CH3COO- | |
| B. | 0.1mol•L-1CuCl2溶液:K+、NH4+、OH-、S2- | |
| C. | 0.1mol•L-1FeCl2溶液:Na+、NH4+、I-、SO42- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1013的溶液:Fe3+、Na+、SO32ˉ、NO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| X | Y | |||
| Z | W | Q |
| A. | X与Y可形成的化合物在5种以上 | |
| B. | 工业上常常通过电解Z的熔融氧化物的方法来获得Z的单质 | |
| C. | 这五种元素形成的简单离子的半径由大到小为:W>Q>X>Y>Z | |
| D. | W、Q两种元素形成的化合物每种原子最外层都达到了8e-稳定结构 |
查看答案和解析>>
科目: 来源: 题型:解答题
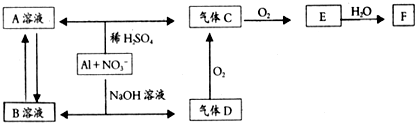

查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 洗净酸式滴定管后,立即装入标准盐酸进行滴定 | |
| B. | 锥形瓶用待测NaOH溶液润洗后,再装入NaOH 溶液进行滴定 | |
| C. | 操作过程中,滴定前平视读数,滴定后仰视读数 | |
| D. | 用酚酞作指示剂滴至红色刚退去,停止滴沄,立即读数 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 滴定次数 | 待测溶液A的体积(mL) | KMnO4标准溶液的体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 20.00 | 0.10 | 20.12 |
| 第二次 | 20.00 | 2.20 | 24.20 |
| 第三次 | 20.00 | 4.30 | 24.28 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com