
科目: 来源: 题型:选择题
| A. | ②④⑥⑦ | B. | ②⑤⑦⑧ | C. | ①③⑤⑥ | D. | ②⑤⑥⑧ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碳酸钠与硫酸氢钠反应 | B. | 碳酸钾溶液与稀盐酸反应 | ||
| C. | 苏打溶液与稀硝酸反应 | D. | 小苏打溶液与稀硫酸反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(Na+)>c(F-) | B. | c(Na+)<c(F-) | ||
| C. | c(Na+)=c(F-) | D. | 无法确定c(Na+)和c(F-)的大小关系 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
| 甲 | C | 0.2 | pH=7 |
| 乙 | 0.2 | 0.1 | pH=a |
| 丙 | 0.2 | 0.2 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在某密闭容器中加入0.5 molN2和1.5 mol H2,充分反应后有的N-H键数为3NA | |
| B. | 标准状况下,2.24 L SO3含有的原子数为0.4 NA | |
| C. | 71 g氯气与足量铁反应过程中转移的电子数为2NA | |
| D. | NA个Fe3+完全水解可以得到NA个氢氧化铁胶体粒子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 16 g | B. | 24 g | C. | 32 g | D. | 64g |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 CO(g)+H2(g).
CO(g)+H2(g).| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
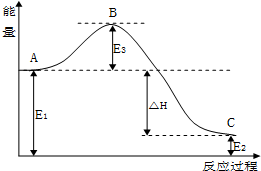
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫酸铜使菌体蛋白质盐析 | |
| B. | 石灰乳使菌体蛋白质水解 | |
| C. | 铜离子在碱性条件下使菌体蛋白质变性 | |
| D. | 蛋白质可以溶解波尔多液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③ | B. | ④⑤⑥ | C. | ①③⑤ | D. | ②④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com