
科目: 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 蒸馏液体时,冷水应从冷凝管的上端进入,下端流出,符合水往低处流原理 | |
| B. | 过滤时,玻璃棒与三层滤纸的一边接触,漏斗下端紧靠烧杯内壁 | |
| C. | 进行蒸发操作时,待固体全部析出时再停止加热 | |
| D. | 分液时,当静置分层后,打开旋塞,使下层液体流出,待下层液刚好流尽后,立即关闭旋塞,再换另一只烧杯,再打开旋塞,将上层液体流出 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | S、Si、Be | B. | O、C、Mg | C. | O、Si、Ca | D. | S、C、He |
查看答案和解析>>
科目: 来源: 题型:解答题
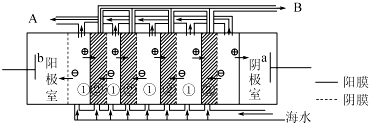
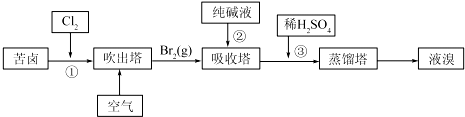
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应中共消耗1.8 mol H2SO4 | B. | 气体甲中SO2与H2的体积比为1:5 | ||
| C. | 反应中共消耗97.5 g Zn | D. | 反应中共转移3 mol电子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢氧化钠溶液中通入少量二氧化硫气体 SO2+OH-═HSO3- | |
| B. | 向硫酸铝中加入过量氨水:Al3++4NH3•H2O═AlO2-+2H2O+4NH4+ | |
| C. | NH4HCO3溶液与足量NaOH溶液共热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+2H2O+CO32- | |
| D. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+$\frac{\underline{\;\;△\;\;}}{\;}$ Fe3++3NO2↑+3H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
| 第2周期 | ⑤ | ⑦ | ⑨ | |||||
| 第3周期 | ① | ③ | ⑥ | ④ | ⑧ | ⑩ | ||
| 第4周期 | ② |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | -(3n-4) | B. | (3n-12) | C. | -(12-3n) | D. | -(n-10) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com