
科目: 来源: 题型:填空题
| 滴定次数 | 盐酸体积(mL) | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 18.10 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.22 |
查看答案和解析>>
科目: 来源: 题型:多选题
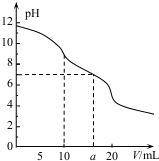 常温下,用 0.1mol•L HCl溶液滴定10.0mL浓度为0.1mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用 0.1mol•L HCl溶液滴定10.0mL浓度为0.1mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )| A. | 当V=0时:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-) | |
| B. | 当V=5时:c(Na+ )>c(HCO3-)>c(CO32- )>c(Cl- ) | |
| C. | 当V=a时:c(Na +)>c(Cl- )>c(H+ )=c(OH- ) | |
| D. | 当V=10时:c(H+ )+c(H2CO3)=c(OH- )+c(CO32-) |
查看答案和解析>>
科目: 来源: 题型:选择题
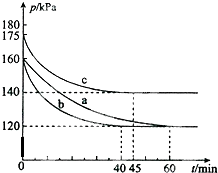 在10L的恒容密闭容器中,发生反应:PCl3(g)+Cl2(g)?PCl5(g)△H<0 若起始时PCl3(g)和Cl2(g)均为0.2mol,在不同条件下进行a、b、c三组实验,每一组实验都是在恒温恒容条件下进行,反应体系总压强随时间的变化如图所示.下列说法中正确的是( )
在10L的恒容密闭容器中,发生反应:PCl3(g)+Cl2(g)?PCl5(g)△H<0 若起始时PCl3(g)和Cl2(g)均为0.2mol,在不同条件下进行a、b、c三组实验,每一组实验都是在恒温恒容条件下进行,反应体系总压强随时间的变化如图所示.下列说法中正确的是( )| A. | 与实验a相比,实验b升高了温度,实验c加入了催化剂 | |
| B. | 从反应开始至刚达平衡时,实验b的化学反应速率ν(PCl5)=5×10-4mol/(L.min) | |
| C. | 实验c达平衡时,PCl3(g)的转化率为 60% | |
| D. | 在实验a条件下,该反应的平衡常数K=100 |
查看答案和解析>>
科目: 来源: 题型:解答题
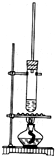
 某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下:
某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 己烷不能使Br2的四氯化碳溶液褪色而己烯能使其褪色 | |
| B. | 葡萄糖与新制的Cu(OH)2悬浊液共热生成砖红色而果糖不能 | |
| C. | 苯酚( )与溴的水溶液反应生成白色沉淀而甲苯不能 )与溴的水溶液反应生成白色沉淀而甲苯不能 | |
| D. | 乙烷与Cl2单质发生取代反应而乙烯与Cl2单质易发生加成反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SiO2>CsCl>CBr4>CF4 | B. | CF4>CCl4>CBr4>Cl4 | ||
| C. | 金刚石>晶体硅>二氧化硅>碳化硅 | D. | NaF>MgF2>AlF3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 坩埚的质量 | 坩埚的质量+晶体质量 | 失水后坩埚的质量+固体质量 |
| 11.70g | 14.2g | 13.2g |
| A. | 晶体中含有不分解的杂质 | B. | 没有放在干燥器中冷却 | ||
| C. | 实验前,晶体表面吸附水 | D. | 没有进行恒重操作 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 混合后的溶液 | 加入的酸 | 酸的浓度/(mol•L-1) | 混合后溶液的pH |
| ① | HA | 0.10 | 8.7 |
| ② | HB | 0.12 | 2 |
| A. | HA是强酸,HB是弱酸 | |
| B. | 升高温度,溶液②中$\frac{c({B}^{-})}{c(N{a}^{+})}$增大 | |
| C. | 溶液①中离子浓度的关系:c(A-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 溶液②中离子浓度的关系:c(Na+)+c(H+)+c(B-)=0.12 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
 已知1-丁醇的沸点为117.7℃,乙酸的沸点为118℃,甲同学拟在浓硫酸作用下,使1-丁醇和乙酸进行酯化反应制乙酸丁酯(反应温度115~125℃)
已知1-丁醇的沸点为117.7℃,乙酸的沸点为118℃,甲同学拟在浓硫酸作用下,使1-丁醇和乙酸进行酯化反应制乙酸丁酯(反应温度115~125℃)查看答案和解析>>
科目: 来源: 题型:解答题
| 实验 编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1 H2C2O4溶液 | 水 | 反应温度/℃ | 反应时间/s |
| ① | 5.0mL | 5.0mL | 0 | 20 | 125 |
| ② | V1 | V2 | 2.0mL | 20 | 320 |
| ③ | 5.0mL | 5.0mL | 0 | 50 | 30 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com