
科目: 来源: 题型:解答题
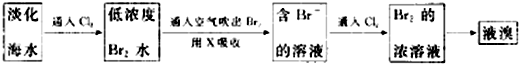
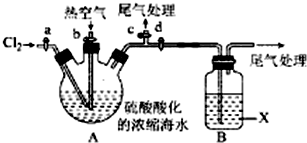

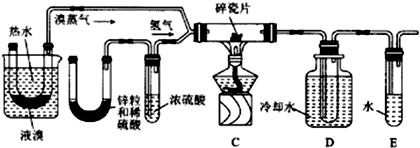
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若浓硫酸不慎洒落在皮肤上应立即用干布拭去,再用大量水冲洗 | |
| B. | 可使蔗糖变黑,体现了浓硫酸的吸水性 | |
| C. | 常温下,浓H2SO4可以用铝制容器贮存,说明铝与浓H2SO4不反应 | |
| D. | 可使胆矾变白,体现了浓硫酸的脱水性 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 第三周期元素的离子半径从左到右逐渐减小 | |
| B. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| C. | ⅥA族元素的氢化物中,稳定性最好的其还原性最强 | |
| D. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 |
查看答案和解析>>
科目: 来源: 题型:解答题
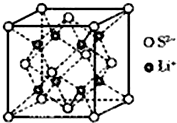 硫的单质及其化合物在工农业生产中的用途非常广泛.回答下列问题:
硫的单质及其化合物在工农业生产中的用途非常广泛.回答下列问题: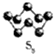 )易溶于CS2,固态时属于分子晶体,其中硫原子杂化轨道类型为sp3.
)易溶于CS2,固态时属于分子晶体,其中硫原子杂化轨道类型为sp3.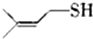 ).
).查看答案和解析>>
科目: 来源: 题型:选择题
| A. | XY | B. | XY2 | C. | XY4 | D. | X2Y3 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
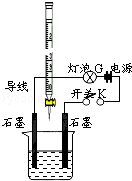 有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.常温下,水的离子积Kw=1×10-14.
有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.常温下,水的离子积Kw=1×10-14.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| B. | 同主族元素的简单阴离子还原性越强,其原子的非金属性越强 | |
| C. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com