
科目: 来源: 题型:选择题
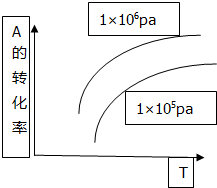 反应mA(g)+B(s)?pC(g)+qD(g)△H>0中A的转化率和温度(T)、压强(P)的关系如图曲线,下列结论正确的是( )
反应mA(g)+B(s)?pC(g)+qD(g)△H>0中A的转化率和温度(T)、压强(P)的关系如图曲线,下列结论正确的是( )| A. | 逆反应为放热反应m<p+q | B. | 逆反应为吸热反应m>p+q | ||
| C. | 正反应为放热反应m<p+q | D. | 正反应为吸热反应m>p+q |
查看答案和解析>>
科目: 来源: 题型:解答题
| 氢氧化物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| Ksp | 2.2×10-20 | 4.0×10-38 | 8.0×10-16 | 1.8×10-11 |
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 甲中负极反应式为Zn-2e-═Zn2+ | |
| B. | 乙中阳极反应式为Ag-e-═Ag+ | |
| C. | 丙中H+向碳棒方向移动 | |
| D. | 丁中电解开始时阳极产生黄绿色气体 |
查看答案和解析>>
科目: 来源: 题型:解答题
| Li3N | NaNH2 | SiBr4 | Mg2Si |
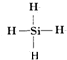
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 分子式为N4C6 | B. | 分子中的氮原子全部是sp2杂化 | ||
| C. | 分子中共形成4个六元环 | D. | 分子间存在氢键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫原子的原子结构示意图: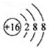 | |
| B. | NH4Cl的电子式: | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}O$ | |
| D. | 纯碱的化学式为NaOH |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径X>Y>Z | B. | 气态氢化物稳定性 HX<HY<HZ | ||
| C. | 非金属性X>Y>Z | D. | 阴离子的还原性X->Y->Z- |
查看答案和解析>>
科目: 来源: 题型:解答题
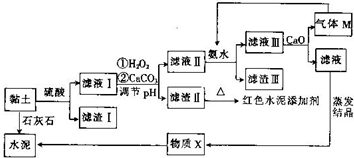 土壤是人类赖以生存的最基本物质,以黏土为原料生产的产品伴随着人类文明的脚步.皖北名胜皇藏峪的黏土,水浸不塌,是生产无机非金属材料的优质原料.某兴趣小组以当地黏土为原料探究彩色水泥、轻质耐火材料的联合生产,其设计的流程如图所示.
土壤是人类赖以生存的最基本物质,以黏土为原料生产的产品伴随着人类文明的脚步.皖北名胜皇藏峪的黏土,水浸不塌,是生产无机非金属材料的优质原料.某兴趣小组以当地黏土为原料探究彩色水泥、轻质耐火材料的联合生产,其设计的流程如图所示.| Fe(OH)2 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀时的pH | 6.3 | 1.9 | 3.4 |
| 完全沉淀时的pH | 8.3 | 3.2 | 4.7 |
 ;向滤液Ⅲ中加放CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).
;向滤液Ⅲ中加放CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).查看答案和解析>>
科目: 来源: 题型:解答题
| 实验步骤 | 向3-4mL 1mol/L AgNO3溶液中滴入1mol/L的Na2SO4溶液至反应完全. |
| 实验现象 | ①产生白色沉淀 |
| 离子方程式 | 2Ag++SO${\;}_{4}^{2-}$=Ag2SO4 |
| 小组讨论交流 | 取上述反应后的清液于试管中滴入适量1mol/L的NaCl 溶液,对于会出现的现象提出了假设 |
| 提出假设 | 假设Ⅰ:反应没有限度 假设Ⅱ:②无现象 |
| 证明假设Ⅱ | 现象③:产生白色沉淀;理由④反应存在限度,溶液中尚有较多Ag+ |
| 离子方程式 | ⑤Ag++Cl-=AgCl↓ |
| 解释 | ⑥加入Cl-产生了大量的白色沉淀,说明Ag++Cl- AgCl↓反应是可逆反应,存在反应限度,所以Ag+不能反应完,才出现这种现象 AgCl↓反应是可逆反应,存在反应限度,所以Ag+不能反应完,才出现这种现象 |
查看答案和解析>>
科目: 来源: 题型:填空题
 A图是物质M和N的溶解度曲线.B图中甲、乙试管分别盛 有M、N的饱和溶液,试管底均有未溶解的M、N固体.向烧杯中加入一种物质后,甲中的固体减少,乙中的固体增加,则加入的物质可能是C
A图是物质M和N的溶解度曲线.B图中甲、乙试管分别盛 有M、N的饱和溶液,试管底均有未溶解的M、N固体.向烧杯中加入一种物质后,甲中的固体减少,乙中的固体增加,则加入的物质可能是C 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com