
科目: 来源: 题型:选择题
| A. | 在钠、钾、铷三种单质中,钠的熔点最高 | |
| B. | 所有碱金属均为银白色 | |
| C. | 同一主族卤素单质从上到下熔沸点依次升高 | |
| D. | 液溴易挥发,可以通过水封的方式进行保存 |
查看答案和解析>>
科目: 来源: 题型:选择题
| C | ||
| A | R | B |
| D |
| A. | 4 Z | B. | 4 Z+10 | C. | 4 Z+5 | D. | 4 Z+14 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SiH4、PH3、H2S、HCl | B. | HF、HCl、HBr、HI | ||
| C. | H2Se、H2S、HCl、HF | D. | NH3、PH3、AsH3、HF |
查看答案和解析>>
科目: 来源: 题型:解答题
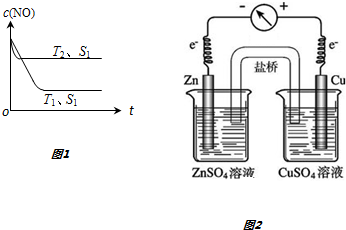
查看答案和解析>>
科目: 来源: 题型:解答题
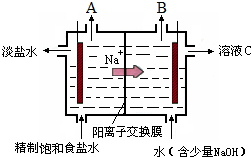 氯碱工业中电解饱和食盐水的原理示意图如图所示:
氯碱工业中电解饱和食盐水的原理示意图如图所示:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 负极反应为:14H2O+7O2+28e-=28OH- | |
| B. | 放电一段时间后,负极周围的pH升高 | |
| C. | 放电过程中OH-向正极移动 | |
| D. | 每消耗1mol C2H6,则电路上转移的电子为14mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 放电时,电池的负极质量减轻 | |
| B. | 放电时,正极周围的pH升高 | |
| C. | 充电时,电池中硫酸的浓度不断减小 | |
| D. | 充电时,阳极发生的反应是PbSO4(s)+2e-═Pb(s)+SO42-(aq) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在Na2CO3、NaHCO3两溶液中,离子种类不相同 | |
| B. | 在NaHCO3溶液中有c(H+)+c(Na+)=c(OH-)+c(CO32-)+c(HCO3-) | |
| C. | 在Na2CO3溶液中有c(OH-)=c(H+)+c(HCO3-)+2 c(H2CO3) | |
| D. | 在Na2CO3溶液中有2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目: 来源: 题型:选择题
| 标号 | HX | YOH | 溶液的体积关系 |
| ① | 强酸 | 强碱 | V(HX)=V(YOH) |
| ② | 强酸 | 强碱 | V(HX)<V(YOH) |
| ③ | 弱酸 | 弱碱 | V(HX)=V(YOH) |
| ④ | 弱酸 | 强碱 | V(HX)=V(YOH) |
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com