
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
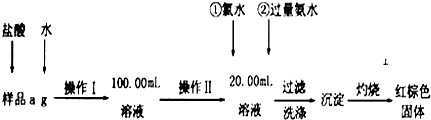
查看答案和解析>>
科目: 来源: 题型:解答题
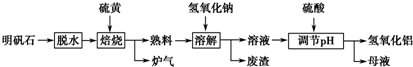
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
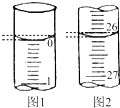 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液(盛放于锥形瓶中)时,选择酚酞作指示剂,请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液(盛放于锥形瓶中)时,选择酚酞作指示剂,请填写下列空白:| 滴定次数 | 0.1000mol-L-1盐酸的体积/mL | ||
| 滴定前 | 滴定后 | 体积/mL | |
| 1 | 0.10 | 26.21 | 26.11 |
| 2 | 1.56 | 31.30 | 29.74 |
| 3 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 漂白粉密封保存,因为潮湿条件下易于CO2反应 | |
| B. | 光导纤维是将太阳能直接转化为电能的常见材料 | |
| C. | 用氢氟酸蚀刻玻璃和用FeCl3溶液蚀刻铜值线路板,均属于氧化还原反应 | |
| D. | 家用消毒柜中通过高压放电使空气产生少量臭氧,这一过程属于物理变化 |
查看答案和解析>>
科目: 来源: 题型:选择题
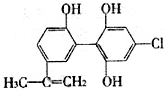 在2010年温哥华冬奥会上,有个别运动员因服用兴奋剂被取消参赛资格.如图是某兴奋剂X的结构简式,下列有关说法正确的是( )
在2010年温哥华冬奥会上,有个别运动员因服用兴奋剂被取消参赛资格.如图是某兴奋剂X的结构简式,下列有关说法正确的是( )| A. | 1molX在一定条件下与足量的氢气反应,最多消耗1molH2 | |
| B. | 1molX与足量的Na反应,最多产生标况下33.6LH2 | |
| C. | 1molX与足量的浓溴水反应,最多消耗5molBr2 | |
| D. | 1molX与足量的NaOH溶液在一定条件下反应,最多消耗5molNaOH |
查看答案和解析>>
科目: 来源: 题型:解答题
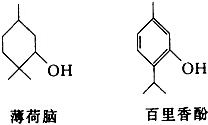 下列物质是几种常见香精的主要成分:
下列物质是几种常见香精的主要成分: .
.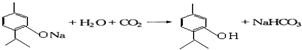 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com