
科目: 来源: 题型:选择题
| A. | 6.0gSiO2晶体中存在的共价键总数为2 NA | |
| B. | 1L 0.1mol•L-1的Na2CO3溶液中含有阳离子的总数为2NA | |
| C. | 标准状况下,2.0gD2O中含有的质子数和中子数均为NA个 | |
| D. | 室温时,pH=12的Ba(OH)2溶液中,氢氧根离子数目为10-2N |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 除去CO2中少量SO2气体,可将气体通过饱和碳酸氢钠溶液洗气 | |
| B. | 除去乙醇中含有的少量水,可加入生石灰,然后进行蒸馏 | |
| C. | 滴定管使用前需要检漏,装溶液时需要润洗 | |
| D. | 除去乙酸乙酯中的少量乙酸,可加入饱和碳酸钠溶液除去乙酸,再进行蒸馏 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 煤的气化、煤的液化和煤的干馏均属于化学变化 | |
| B. | 淀粉、纤维素、油脂、蛋白质均属于高分子化合物 | |
| C. | 棉花、羊毛和蚕丝都属于天然高分子 | |
| D. | 陶瓷、水泥和玻璃均属于硅酸盐材料 |
查看答案和解析>>
科目: 来源: 题型:解答题
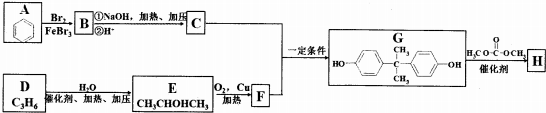
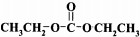 +2ROH$\stackrel{催化剂}{→}$
+2ROH$\stackrel{催化剂}{→}$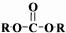 +2CH3CHOH(R为烃基)
+2CH3CHOH(R为烃基)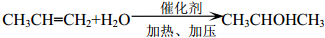 .
.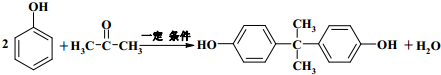 .
.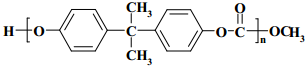 .
.查看答案和解析>>
科目: 来源: 题型:解答题
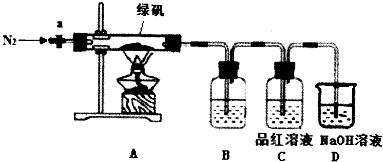
查看答案和解析>>
科目: 来源: 题型:解答题
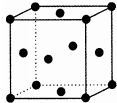 X、Y、Z、R、T为前四周期元素,且原子序数依次增大,Y与R同族,Y的氢化物常温下为无色无味的液体,X与Y可形成直线形分子XY2,Z的基态原子p轨道上电子总数为7,T2+离子的3d轨道上有3个电子.
X、Y、Z、R、T为前四周期元素,且原子序数依次增大,Y与R同族,Y的氢化物常温下为无色无味的液体,X与Y可形成直线形分子XY2,Z的基态原子p轨道上电子总数为7,T2+离子的3d轨道上有3个电子.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若溶液pH=7,则c(A-)=c(HA) | |
| B. | 若c(A-)>c(HA),则溶液中水电离的c(H+)<1.0×10-7mol/L | |
| C. | 若pH>7,加水稀释c(A-)/c(HA)增大 | |
| D. | 溶液中,c(A-)=2c(H+)+c(HA)-2c(OH-) |
查看答案和解析>>
科目: 来源: 题型:多选题
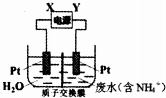
| A. | 直流电源中X为负极 | |
| B. | 阳极反应为2NH4+-6e-=N2↑+8H+ | |
| C. | 阴极反应为2H2O+2e-=H2↑+2OH- | |
| D. | 当有6mol电子转移时,质子交换膜两侧电解质溶液质量变化差为32 g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 molNaN3所含阴离子总数为3NA | |
| B. | 常温常压下,28 g乙烯气体中σ键与π键数目之和为6NA | |
| C. | 标准状况下,22.4L C12通入到足量FeBr2溶液中,被氧化的Br-数目为2NA | |
| D. | 500 mL 18 mol/L的H2SO4溶液与足量Cu共热,电子转移数目为9NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 检验溴乙烷是否发生消去反应 | 溴乙烷与NaOH乙醇溶液共热,将产物通入到Br2的CC14溶液中,观察溶液是否褪色 |
| B | 验证电离H+的能力 HClO>HCO3- | 向NaHCO3溶液中加入新制氯水,观察溶液中是否有气泡冒出 |
| C | 验证H2O与NH3的配位能力强弱 | 向CuSO4溶液中逐滴加入过量NH3•H2O,观察蓝色溶液是否最终转化为深蓝色溶液 |
| D | 检验Na2O2的强氧化性 | 向FeSO4溶液中加入少量Na2O2粉末,观察是否有红褐色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com