
科目: 来源: 题型:选择题
| A. | 在医疗上碳酸钠可用于治疗胃酸过多 | |
| B. | 家用铁锅用水清洗后置于干燥处,能减缓电化学腐蚀 | |
| C. | 清洁能源所用光电池的生产材料主要是高纯度的二氧化硅 | |
| D. | 推广使用煤液化技术,可减少二氧化碳等温室气体的排放 |
查看答案和解析>>
科目: 来源: 题型:解答题
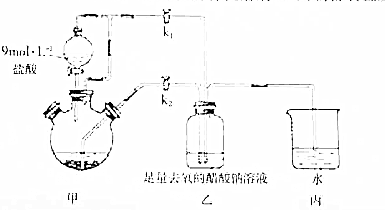 ①检查装置气密性后,往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液.
①检查装置气密性后,往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液. 查看答案和解析>>
科目: 来源: 题型:解答题
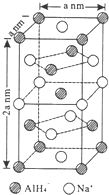 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.  .
.  .
.  (标明配位键).
(标明配位键).查看答案和解析>>
科目: 来源: 题型:解答题
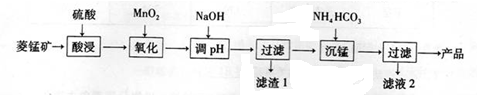
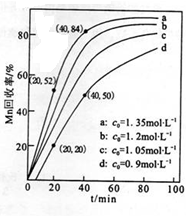
查看答案和解析>>
科目: 来源: 题型:解答题
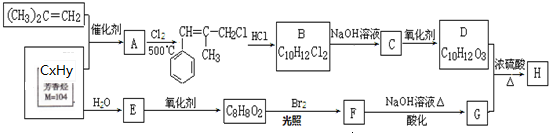
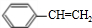
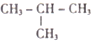 合成(CH3)2C=CH2的路线为:
合成(CH3)2C=CH2的路线为: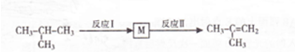 ,反应Ⅰ的条件为光照,写出反应Ⅱ的化学方程式
,反应Ⅰ的条件为光照,写出反应Ⅱ的化学方程式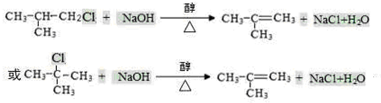
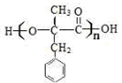
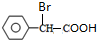 +2NaOH $→_{△}^{水}$
+2NaOH $→_{△}^{水}$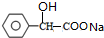 +NaBr+H2O
+NaBr+H2O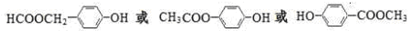 .
.查看答案和解析>>
科目: 来源: 题型:解答题
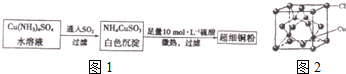
查看答案和解析>>
科目: 来源: 题型:解答题
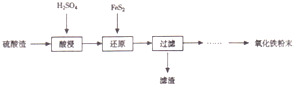
 (填试剂)检验滤液中含有Fe3+.“酸浸”后Fe3+可被空气中O2氧化(用离子反应方程式表示)4Fe2++O2+4H+=4Fe3++2H2O
(填试剂)检验滤液中含有Fe3+.“酸浸”后Fe3+可被空气中O2氧化(用离子反应方程式表示)4Fe2++O2+4H+=4Fe3++2H2O| 沉淀物 | Fe(OH)3 | A1(0H)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
查看答案和解析>>
科目: 来源: 题型:解答题
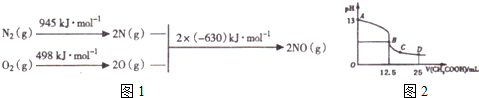
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (×lO-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO) (×lO-3mol•L-1) | 2.70 | 2.15 | 1.95 | 1.85 | 1.80 | 1.80 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 某醋酸溶液的pH=a.将此溶液稀释10倍后,溶液的pH值为b.则b=a+1 | |
| B. | CH3OOH和CH3COONa混合溶液不可能存在:c (CH3COOH)>c (CH3COO-)>c (H+)>c (Na+)>c (0H-) | |
| C. | 常温下.将pH=3的H2SO4和pH=11的一元碱BOH-溶液等体积混合,所得溶液可能为中性或酸性 | |
| D. | 常溫下,浓度均为O.1mol•L-1的①CH3COOH溶液②NaOH溶液③CH3OONa 溶液中,水的电离程度③>①>② |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  实验:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 | |
| B. |  实验:烧杯内Na2SiO3溶液变浑浊,可证明非金属性C>Si | |
| C. |  实驗:微笑热稀HN02,片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. |  实驗:利用该实驗装置可证明氧化性:Cl2>Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com