
科目: 来源: 题型:选择题
| A. | 1 | B. | l-a | C. | 2-lga | D. | 3-lga |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 最外层电子数:E>F | |
| B. | 等物质的量的E和F分别与足量稀盐酸反应,产生氢气的物质的量:E>F | |
| C. | Ea+和Fb+有相同的电子层结构(a<b) | |
| D. | 25℃时,Ksp[E(OH)a]>Ksp[F(OH)b] |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X不一定属于烃的衍生物 | |
| B. | 能与NaHCO3反应的X有3种 | |
| C. | X的某些同分异构体之间可能发生取代反应 | |
| D. | 能与NaOH溶液反应的X都含有相同的官能团 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 长期放置的漂白粉是因与空气中的氧气发生反应而变质 | |
| B. | 粗硅提纯是利用H2作还原剂,将硅从其氯化物中还原出来 | |
| C. | 利用半透膜除去海水中的NaCl、MgCl2等离子化合物可获得淡水 | |
| D. | 工业上用铝热反应来冶炼Fe、Cr、Mn、V等稀有金属 |
查看答案和解析>>
科目: 来源: 题型:解答题


 ;D的核磁共振氢谱共有3组峰.
;D的核磁共振氢谱共有3组峰.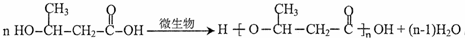 .
. 的合成路线图为
的合成路线图为 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 ,D原子的价层电子排布式为3s23p3.
,D原子的价层电子排布式为3s23p3.查看答案和解析>>
科目: 来源: 题型:解答题
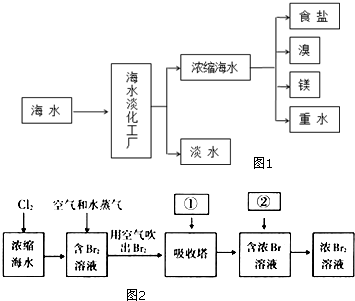 浩瀚的海洋是一个巨大的资源宝库,蕴藏着丰饶的矿产,是宝贵的化学资源,如图1是海水加工的示意图,根据如图回答问题.
浩瀚的海洋是一个巨大的资源宝库,蕴藏着丰饶的矿产,是宝贵的化学资源,如图1是海水加工的示意图,根据如图回答问题.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
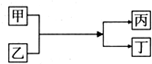
| A. | 若甲为铜,丁为氯化亚铁,则乙一定是氯化铁 | |
| B. | 若甲为水,丁为氢氧化钠,则丙一定是氢气 | |
| C. | 若甲为铝,丁为铁,则乙一定是氧化铁 | |
| D. | 若甲为镁,丁为氢气.则乙一定是酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 化学键 | H-H | F-F | H-F | H-Cl | H-1 |
| E(kJ/mol) | 436.0 | 157 | 568 | 431.8 | 298.7 |
| A. | 表中最稳定的化学键是H-F | |
| B. | 431.8 kJ/mol>E(H-Br)>298.7 kJ/mol | |
| C. | H2(g)→2H(g)△H=+436.0 kJ/mol | |
| D. | H2(g)+F2(g)→2HF(g)△H=-25kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com