
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子式为C5H12的化合物,其一氯代物种类(不考虑立体异构)不可能是2种 | |
| B. | 棉花、羊毛、蚕丝均属于天然纤维 | |
| C. | 乙二酸二乙酯、乙二酸乙二酯、二乙酸乙二酯它们互为同分异构体 | |
| D. | 石油裂化、油脂皂化和煤的干馏都是化学变化,而石油的分馏和蛋白质的盐析都是物理变化 |
查看答案和解析>>
科目: 来源: 题型:解答题
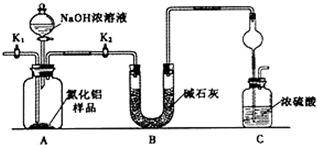
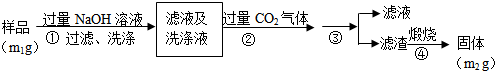
查看答案和解析>>
科目: 来源: 题型:解答题
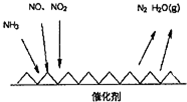
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铁溶于稀硝酸,溶液变为浅绿色Fe+4H++NO3 --=Fe3++NO↑+2H2O | |
| B. | 向K2Cr2O7溶液中加少量浓硫酸,溶液变为黄色Cr2O7 2-(橙色)+H2O?2CrO4 2-(黄色)+2H+ | |
| C. | 向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝4H++4I-+O2=2I2+2H2O | |
| D. | 稀的氨水溶液吸收了少量的二氧化碳气体NH3•H2O+CO2=NH4++HCO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 19g H3O+ 共用的电子对数为8NA | |
| B. | 将含有NO2与N2O4分子共约NA个的混合气,温度降至标准状况,气体体积约为22.4L | |
| C. | 含10.6g Na2CO3溶液中的离子总数为0.3NA | |
| D. | 0℃、101KPa下,22.4L氦气含质子的数目为2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 焰火的五彩缤纷是某些金属元素化学性质的体现 | |
| B. | 高纯度的单晶硅用于制造登月车的光电池和光导纤维 | |
| C. | 可溶性铜盐有毒,但在生命体中,铜是一种不可缺少的微量元素 | |
| D. | 用明矾可以将自来水净化成纯净水 |
查看答案和解析>>
科目: 来源: 题型:解答题
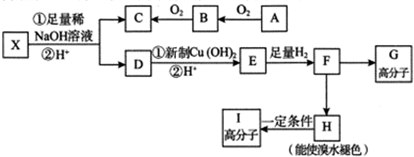
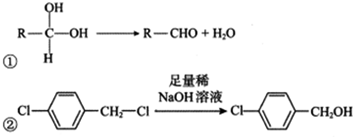
 .
. $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O;
+H2O;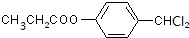 +4NaOH$→_{△}^{水}$CH3CH2COONa+
+4NaOH$→_{△}^{水}$CH3CH2COONa+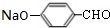 +2H2O+2NaCl;
+2H2O+2NaCl;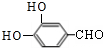 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com