
科目: 来源: 题型:选择题
| A. | 溶液呈酸性说明草酸是弱酸 | B. | c(K+)+c(H+)═c(HC2O4-)+c(OH-)+2c(C2O42-) | ||
| C. | c(K+)>c(HC2O4-)>c(C2O42-)>c(H+) | D. | c(H2C2O4)>c(C2O42-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 离子或分子 | 条件 |
| ① | K+、NO3-、Cl-、HS- | c(K+)<c(Cl-) |
| ② | Cu2+、NO3-、S2-、Cl- | 滴加盐酸立即有气体产生 |
| ③ | NH4+、Fe3+、SO42-、HCOOH | 滴加NaOH浓溶液立刻有气体产生 |
| ④ | Na+、HCO3-、Mg2+、SO42- | 逐滴滴加氨水立即有沉淀产生 |
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 明矾、硫酸铁作净水器 | |
| B. | 医用双氧水做杀菌消毒剂 | |
| C. | 铁粉、碳粉和氯化钠的混合物作食品的去氧剂 | |
| D. | CaO2作运输水产品的供氧剂 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 滴定次数 | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | |
| 1 | 1.04 | 25.03 |
| 2 | 1.98 | 25.99 |
| 3 | 3.20 | 25.24 |
查看答案和解析>>
科目: 来源: 题型:解答题
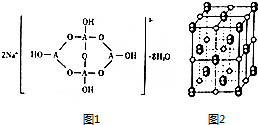 已知A、B、C、D、E五种元素是周期表中前四周期元素,且原子序数依次增大.其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子.D、E为同周期元素且分别位于s区和d区.五种元素所有的s能级电子均为全充满.E的d能级电子数等于A、B、C最高能层的p能级电子数之和.回答下列问题:
已知A、B、C、D、E五种元素是周期表中前四周期元素,且原子序数依次增大.其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子.D、E为同周期元素且分别位于s区和d区.五种元素所有的s能级电子均为全充满.E的d能级电子数等于A、B、C最高能层的p能级电子数之和.回答下列问题: .
.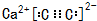 ,若晶胞的长宽高分别为520pm、520pm和690pm,该晶体密度为2.28g/cm3(保留到小数点后两位).
,若晶胞的长宽高分别为520pm、520pm和690pm,该晶体密度为2.28g/cm3(保留到小数点后两位).查看答案和解析>>
科目: 来源: 题型:解答题
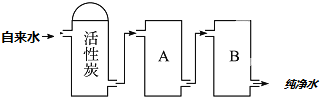
查看答案和解析>>
科目: 来源: 题型:解答题
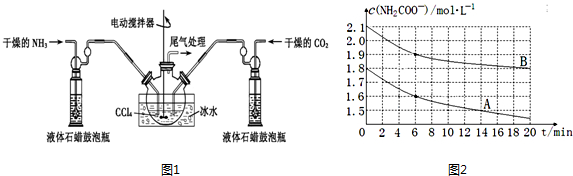
查看答案和解析>>
科目: 来源: 题型:解答题
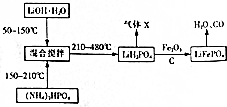
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH3CH2Br难溶于水 | |
| B. | 该反应属于取代反应 | |
| C. | CH3CH2Br与HBr均属于电解质 | |
| D. | 若原料完全反应生成上述产物,CH3CH2Br与NH3的物质的量之比为2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com