
科目: 来源: 题型:选择题

| A. | 电池工作时,甲烧杯中由烧杯中由水电离出的c(H+)逐渐减小 | |
| B. | 电池工作时,盐桥中的“K+”移向甲烧杯,外电路的方向是从b到a | |
| C. | 当电路中有1.204×1021个电子转移时,乙烧杯中溶液的pH约为2 | |
| D. | 乙池中的氧化产物为SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目: 来源: 题型:选择题
 六种元素周期表中的位置如图,其中只有一种不是短周期元素,只有一种是金属元素,下列说法正确的是( )
六种元素周期表中的位置如图,其中只有一种不是短周期元素,只有一种是金属元素,下列说法正确的是( )| A. | 简单离子半径大小:Q>Y>X | |
| B. | 最简单气态氢化物的沸点高低:Y>Z | |
| C. | Q的最高价氧化物可与X的氢化物直接反应 | |
| D. | X与Y既可存在于同一共价化合物中,也可存在于同一离子化合物中 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,2.24L苯中含C-C数目为0.3NA | |
| B. | 常温下9.2gNO2和N2O4的混合气体中含有的氧原子数目为0.4NA | |
| C. | 常温下,1.0LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA | |
| D. | 在反应KCO2+6HCl═KCl+3Cl2↑+3H2O中能生成转移电子数为6NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 利用海水制取氯化钠、烧碱、纯碱、氯气等物质都发生了氧化还原反应 | |
| B. | 蛋白质、葡萄糖、纤维素、油脂等都能在人体内水解并提供能量 | |
| C. | 为了提高生活用水的卫生标准,自来水厂常使用Cl2和CuSO3•5H2O进行消毒、净化、以改善水质 | |
| D. | 塑料、合成橡胶和纤维这三大合成材料,都主要以石油、煤和天然气为原料生产的 |
查看答案和解析>>
科目: 来源: 题型:解答题
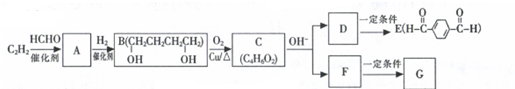

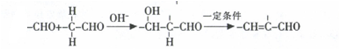
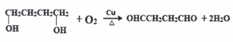 .
.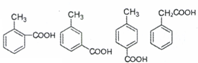 (任意一种)(任写一种).
(任意一种)(任写一种).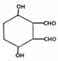 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$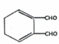 +H2O.
+H2O.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
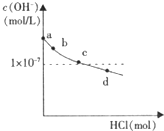
| 坐标对应点 | a | b | c | d |
| n(SO32-):n(HSO32-) | / | 91:9 | 1:1 | 9:91 |
| pH | >8.2 | 8.2 | 7.2 | 6.2 |
| A. | b点溶液中:水电离出的c(OH-)=1×10-5.8mol/L | |
| B. | c点溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+) | |
| C. | d点溶液中HSO3-的电离大于水解 | |
| D. | d点溶液中:c(Na+)<c(SO32-)+c(HSO3-)+c(Cl-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向盛有2mL0.1mol/L AgNO3溶液的试管中,先滴加几滴0.1mol/L KCl溶液,再滴加0.1mol/L KI溶液 | 先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 将适量CO2和SO2分别通入装有Ba(NO3)2溶液的两支试管中 | 一支试管出现白色沉淀,另一支试管无明显现象 | 出现的白色沉淀是BaSO3 |
| C | 取少量KClO3晶体溶于适量的蒸馏水,再加入硝酸酸化的AgNO3溶液 | 产生白色沉淀 | KClO3中含Cl- |
| D | 湿润的KI淀粉试纸靠近气体Y | 试纸变蓝 | Y可能是Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na+、Mg2+、SO42-、Cl-不能大量共存,只是因为:Mg2++SO42-═MgSO4↓ | |
| B. | H+、Fe2+、NO3-ClO-不能大量共存,只是因为:H++ClO-═HClO | |
| C. | K+、Ca2+、SiO32-、Cl-不能大量共存,只是因为:Ca2++SiO32-═CaSiO3↓ | |
| D. | Fe3+、NH4+、HCO3-、SCN-不能大量共存,这是因为:Fe3++3SCN-═Fe(SCN)3↓ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 单晶硅常用于制光导纤维 | |
| B. | 可用醋酸除去水瓶中的水垢 | |
| C. | 开发氢能源汽车,可减少PM2.5的排放 | |
| D. | 工业合成氨属于人工固氮 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com