
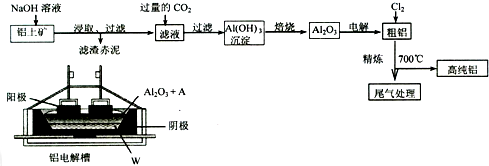
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2Q1+Q2>4Q3 | |
| B. | Q1+Q2<Q3 | |
| C. | 1mol氧气和2mol氢气的总能量高于1mol水的总能量 | |
| D. | 1mol氧气和2mol氢气的总能量低于1mol水的总能量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲、乙处于同一周期 | |
| B. | 它们中有一种元素位于第ⅥA族 | |
| C. | 乙的最高价氧化物与甲的单质反应是吸热反应 | |
| D. | 简单甲离子的电子式为:Mg2+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3:2:1 | B. | 1:1:1 | C. | 1:2:3 | D. | 6:3:2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含有少量碳酸氢钙和氯化钙的水是永久硬水 | |
| B. | 明矾有净水作用,所以用明矾处理硬水,可以使硬水软化 | |
| C. | 用离子交换剂处理硬水,只能软化暂时硬水,不能软化永久硬水 | |
| D. | 只具有暂时硬度的水经加热煮沸后,可变成软水 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | I在DB2中燃烧生成两种化合物 | |
| B. | A、H、J的离子半径由大到小顺序是H>J>A | |
| C. | G元素的单质不存在同素异形体 | |
| D. | A单质能从B的氢化物中置换出B单质来 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 所有的化学反应都伴随着物质变化和能量变化 | |
| B. | 断裂化学键要吸收能量、形成化学键要释放能量是化学反应中能量变化的主要原因 | |
| C. | 吸热反应是一定需要加热才能发生的反应 | |
| D. | 根据反应物总能量和生成物总能量的相对大小可判断反应是释放能量还是吸收能量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②④ |
查看答案和解析>>
科目: 来源: 题型:解答题
| 阳离子 | Ag+、Na+ |
| 阴离子 | NO3-、SO42-、Cl- |
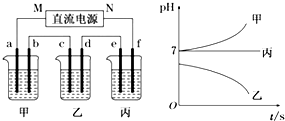
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com