
科目: 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | ① | |||||||
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑨ | |||||||
| 5 | ⑩ |
查看答案和解析>>
科目: 来源: 题型:解答题
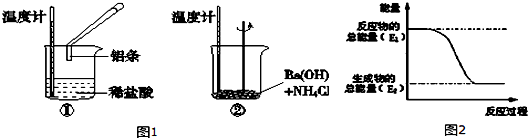
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 正极通入H2,发生还原反应 | |
| B. | 负极通入H2,发生还原反应 | |
| C. | 总反应式为2H2+O2=2H2O | |
| D. | 导电离子为质子,且在电池内部由正极定向移向负极 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 元素原子量的递增,量变引起质变 | |
| B. | 元素原子的核外电子排布呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素的原子半径呈周期性变化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 生石灰和水 | B. | 熟石灰和水 | C. | 浓硫酸和水 | D. | 氯化钠和水 |
查看答案和解析>>
科目: 来源: 题型:解答题
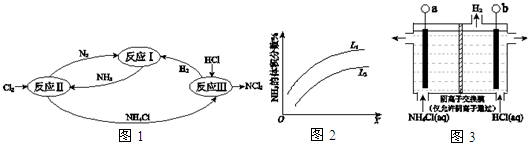
查看答案和解析>>
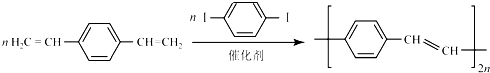
科目: 来源: 题型:解答题
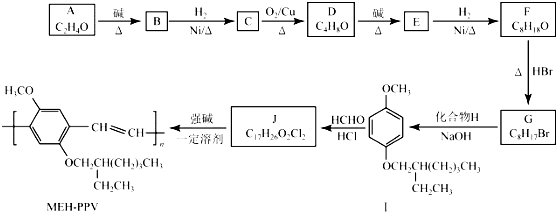
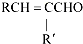 +H2O (R、R′表示烃基或氢)
+H2O (R、R′表示烃基或氢) (R、R′表示烃基烷氧基)
(R、R′表示烃基烷氧基)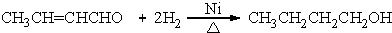 .
.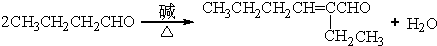 .
.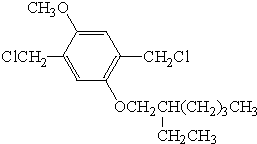 .
.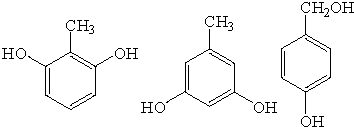 .
.
 、
、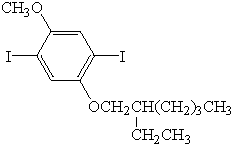 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | MnO2吸收SO2的反应:MnO2+SO2═MnSO4 | |
| B. | MnO2作为碱性电池正极材料时的放电反应:MnO2+e-+H+═MnOOH | |
| C. | MnSO4与KMnO4反应制备MnO2:2MnO4-+3Mn2++2H2O═5MnO2+4H+ | |
| D. | 尾气中的SO2 还可用足量的氨水吸收:SO2+2NH3•H2O═2NH4++SO32-+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
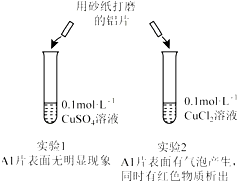
| A. | 由实验1 可以得出结论:金属铝的活泼性弱于金属铜 | |
| B. | 实验2 中生成红色物质的离子方程式:Al+Cu2+═Al3++Cu | |
| C. | 溶液中阴离子种类不同是导致实验1、2 出现不同现象的原因 | |
| D. | 由上述实验可推知:用砂纸打磨后的铝片分别与浓度均为0.2mol•L-1的盐酸和硫酸反应,后者更剧烈 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 实验室可用蒸馏法提纯工业乙醇 | |
| B. | 葡萄糖用于制镜业是利用了葡萄糖的还原性 | |
| C. | 1mol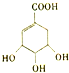 最多可与4 mol NaOH 发生反应 最多可与4 mol NaOH 发生反应 | |
| D. | 1-氯丙烷和2-氯丙烷分别与NaOH 乙醇溶液共热,都可得到丙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com