
科目: 来源: 题型:选择题
| A. | 全部 | B. | ②③④⑥ | C. | ③④⑥⑦⑧ | D. | ③④⑤⑥⑦⑧ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碱性NaOH>Mg(OH)2>Al (OH)3 | |
| B. | 原子半径Na>Mg>Al | |
| C. | 阳离子的氧化性Na+<Mg2+<Al3+ | |
| D. | Na与冷水剧烈反应,Mg与冷水反应微弱;镁粉与铝粉分别与同浓度稀HCl反应,镁粉比铝粉反应剧烈 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H三种核素的性质不同 | |
| B. | 16O2、18O2彼此是同位素 | |
| C. | 14N、14C两种核素的中子数相同,质子数不同 | |
| D. | 白磷与红磷是磷元素的两种同素异形体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 第ⅢB族元素种类最多 | |
| B. | 只有第3列到第12列全部是金属元素 | |
| C. | 周期数大于或等于族的序数时,一定是金属元素 | |
| D. | 是按原子的质量数由小到大的顺序编制的 |
查看答案和解析>>
科目: 来源: 题型:解答题
| Cu(OH)2 | CuOH | CuCl | Cu2O | |
| 颜色 | 蓝色 | 黄色 | 白色 | 砖红色 |
| Ksp(25℃) | 1.6×10-19 | 1.0×10-14 | 1.2×10-6 | - |
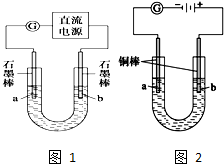
查看答案和解析>>
科目: 来源: 题型:解答题

| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| B. | 乳酸[CH3CH(OH)COOH]中存在一个手性碳原子 | |
| C. | 许多过渡金属离子对多种配体具有很强的结合力,因而,只有过渡金属才能形成配合物 | |
| D. | 已知酸性:H3PO4>HClO,是因为H3PO4分子中有1个非羟基氧原子而HClO为0 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 最高正化合价:③>②>① | B. | 单质氧化性:③>①>② | ||
| C. | 电负性:③>②>① | D. | 原子半径:③>②>① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com