
科目: 来源: 题型:选择题
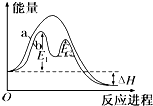
| A. | 改变催化剂,可改变该反应的活化能 | |
| B. | 该反应为吸热反应,热效应等于△H | |
| C. | 反应过程a有催化剂参与 | |
| D. | 有催化剂条件下,反应的活化能等于E1+E2 |
查看答案和解析>>
科目: 来源: 题型:解答题
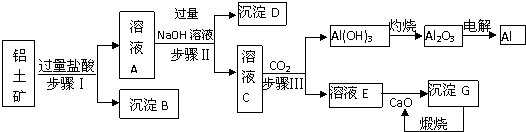
查看答案和解析>>
科目: 来源: 题型:解答题
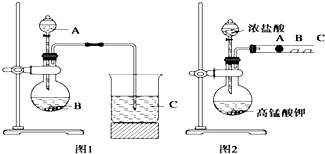 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素碳与硅的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红色试纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.根据图1回答:
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素碳与硅的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红色试纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.根据图1回答:查看答案和解析>>
科目: 来源: 题型:解答题

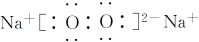
查看答案和解析>>
科目: 来源: 题型:解答题
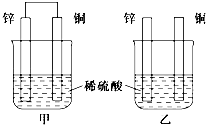 (1)将纯锌片和纯铜片按下图方式插入相同浓度的稀硫酸中一段时间,回答下列问题:
(1)将纯锌片和纯铜片按下图方式插入相同浓度的稀硫酸中一段时间,回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1:1 | B. | 1:3 | C. | 2:3 | D. | 1:2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 通入甲烷的一极为正极,该极c(OH-)减小 | |
| B. | 通入甲烷的一极的电极反应为CH4-8e-+3H2O=CO32-+10H+ | |
| C. | 通入氧气一极发生还原反应,电极反应为O2+2H2O+4e-=4OH- | |
| D. | 该电池工作时,溶液中的阴离子向正极移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 元素周期表是元素周期律的具体表现形式 | |
| B. | 元素的性质随原子序数递增而呈现周期性变化的根本原因是随原子序数的递增原子的核外电子排布呈现周期性变化 | |
| C. | 同周期第IA族与第VA族原子序数之差可能是4、14、28 | |
| D. | 同主族原子序数之差不可能是:10、16、18、26、34、36、50 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com