
科目: 来源: 题型:选择题
| A. | 凡是分子组成相差一个或若干个CH2原子团的物质,彼此一定是同系物 | |
| B. | 分子式为C5H12O且氧化产物能发生银镜反应的醇有6种 | |
| C. | 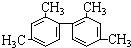 分子中至少有11个碳原子处于同一平面 分子中至少有11个碳原子处于同一平面 | |
| D. | 1mol β-紫罗兰酮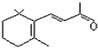 与1mol H2发生加成反应可得到3种不同产物 与1mol H2发生加成反应可得到3种不同产物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若HAOm是强酸,则HBOm也一定为强酸 | |
| B. | 若B为非金属元素,则A可能为金属元素,若B为金属元素,则A可能为非金属元素 | |
| C. | 常温下,若B的简单氢化物是气体,则A的简单氢化物可能是液体 | |
| D. | 若B(OH)m是强碱,则A(OH)m也是强碱 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验序号 | 实验步骤 |
| ① | 将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 |
| ② | 向新制得的Na 2S溶液中滴加新制的氯水 |
| ③ | 将一小块金属钠放入滴有酚酞溶液的冷水中 |
| ④ | 将镁条投入稀盐酸中 |
| ⑤ | 将铝条投入稀盐酸中 |
| ⑥ | 向AlCl 3溶液中滴加NaOH溶液至过量 |
| 实验序号 | 实验步骤(略) | 实验现象 | 化学方程式 |
| ① | |||
| ② | |||
| ③ | |||
| ④ | |||
| ⑤ | |||
| ⑥ |
查看答案和解析>>
科目: 来源: 题型:解答题
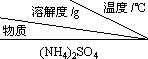 | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.3 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2SO4•FeSO4•6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |


查看答案和解析>>
科目: 来源: 题型:解答题
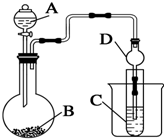 某兴趣小组设计如下实验来证明同周期元素Cl和S的非金属性强弱.
某兴趣小组设计如下实验来证明同周期元素Cl和S的非金属性强弱.查看答案和解析>>
科目: 来源: 题型:解答题

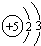 ;
;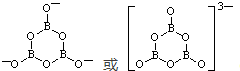 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com