
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
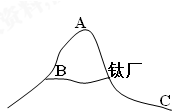 金属钛冶炼过程中得到MgCl2,将熔融态MgCl2电解可得到金属镁和Cl2,氯气可制得漂白液、“84消毒液”等生活用品,试回答下列问题:
金属钛冶炼过程中得到MgCl2,将熔融态MgCl2电解可得到金属镁和Cl2,氯气可制得漂白液、“84消毒液”等生活用品,试回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
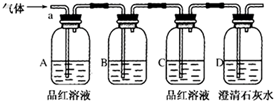
查看答案和解析>>
科目: 来源: 题型:解答题
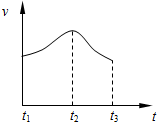 把除去氧化膜的镁条投入到盛有稀HCl的试管中,发现氢气发生的速率变化情况如图所示.
把除去氧化膜的镁条投入到盛有稀HCl的试管中,发现氢气发生的速率变化情况如图所示.查看答案和解析>>
科目: 来源: 题型:解答题
| 名称 | 甲醇 | 二甲胺 | 二甲基甲酰胺 | 甲醚 | 碳酸二甲酯 |
| 结构式 | CH3OH | (CH3)2NH | (CH3)2NCHO | CH3OCH | (CH3O)2CO |
| 沸点(℃) | 64.7 | 7.4 | 153℃ | -24.9 | 90℃ |
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
| CH3OH | CH3OCH3 | H2O | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
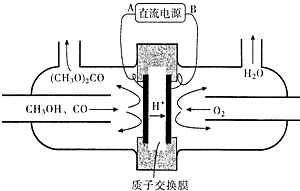
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ①③⑥⑦ | C. | ②③④⑦ | D. | ②④⑥⑧ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 白、红、白、蓝 | B. | 白、白、白、蓝 | C. | 白、黑、白、蓝 | D. | 红、黑、红、蓝 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 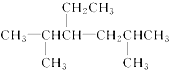 的正确名称是2,5-二甲基-4-乙基己烷 的正确名称是2,5-二甲基-4-乙基己烷 | |
| B. | 胡椒酚的结构简式为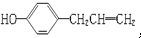 胡椒酚在水中的溶解度小于苯酚在水中的溶解度 胡椒酚在水中的溶解度小于苯酚在水中的溶解度 | |
| C. | 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n | |
| D. | 2013年11月出现的“夺命快递”--化学品为氟乙酸甲酯,它是一种无色透明液体,不溶于水,易溶于乙醇、乙醚,属于酯类,也属于卤代烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com