
科目: 来源: 题型:填空题
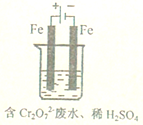 工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理.常用的处理方法有两种.
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理.常用的处理方法有两种.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
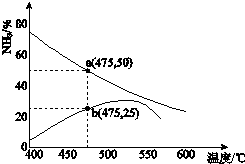 自然界中氮元素有多种存在形式
自然界中氮元素有多种存在形式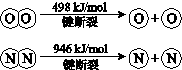
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(OH-)/c(H+)═10-12的溶液中:NH4+、Cu2+、NO3-、Cl-能大量共存 | |
| B. | 通入过量SO2气体的溶液中:HSO3-、NO3-、Ba2+不能大量共存 | |
| C. | 向足量NaHSO4溶液中逐渐滴入Ba(HCO3)2溶液的离子方程式为:HCO3-+Ba2++H++SO42-═BaSO4↓+H2O+CO2↑ | |
| D. | 向Fe(NO3)3溶液中加入HI溶液的离子方程式为:2Fe3++2I-═2Fe2++2I2 |
查看答案和解析>>
科目: 来源: 题型:选择题
 25℃时,在25mL 0.1mol•L-1的NaOH溶液中,逐滴加入0.2mol•L -1的CH3COOH溶液,溶液的pH与醋酸体积关系如图所示,下列分析不正确的是( )
25℃时,在25mL 0.1mol•L-1的NaOH溶液中,逐滴加入0.2mol•L -1的CH3COOH溶液,溶液的pH与醋酸体积关系如图所示,下列分析不正确的是( )| A. | B点的横坐标a>12.5 | |
| B. | C点时溶液中有:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | D点时溶液中有:c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| D. | 曲线上A、B间的任意一点,溶液中都有:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 四种元素中有两种元素在第二周期 | |
| B. | W所在主族的元素的原子次外层电子数不可能为18 | |
| C. | X、Y、Z的最高价氧化物对应的水化物之间能两两反应 | |
| D. | 工业上获得X、Y单质的方法主要是电解其熔融的氯化物 |
查看答案和解析>>
科目: 来源: 题型:解答题
 ,在这反应中该强酸展现酸性,氧化性.
,在这反应中该强酸展现酸性,氧化性.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2:1:1 | B. | 3:2:1 | C. | 3:1:2 | D. | 4:1:3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应时构成分子的原子种类发生改变 | |
| B. | 分子、原子、离子都是构成物质的微粒 | |
| C. | 不同元素最本质的区别在是相对原子质量不同 | |
| D. | 原子不显电性,是因为原子中不存在带电的粒子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com