
科目: 来源: 题型:解答题
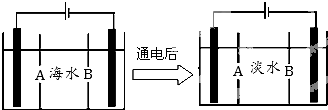
查看答案和解析>>
科目: 来源: 题型:解答题
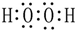 .
.
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | IA | IIA | ⅢA | ⅣA | VA | VIA | VIIA | 0 |
| ① | ② | ③ | ||||||
| ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
 ;
;查看答案和解析>>
科目: 来源: 题型:选择题
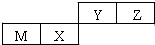
| A. | 原子半径Z>Y | |
| B. | Y的最高价氧化物对应水化物的酸性比X 的弱 | |
| C. | M和Y的最高价氧化物对应水化物之间能相互反应 | |
| D. | Y的气态氢化物比Z气态氢化物稳定 |
查看答案和解析>>
科目: 来源: 题型:解答题
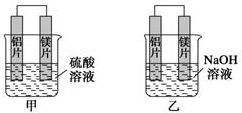
查看答案和解析>>
科目: 来源: 题型:解答题
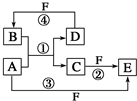 A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).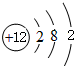 ,反应④的化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
,反应④的化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com