
科目: 来源: 题型:选择题
| A. | ①④ | B. | ③② | C. | ④ | D. | ③④ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:B>A>C>D | B. | 原子序数:d>c>b>a | ||
| C. | 离子半径:D ->C 2->B +>A 2+ | D. | 离子的还原性:D ->C 2- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将少量Cl2通入FeBr2溶液中:Cl2+2Br-═Br2+2Cl- | |
| B. | 将足量Cl2通入FeBr2溶液中:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 将少量Cl2通入FeI2溶液中:2Fe2++2I-+3Cl2═2Fe3++2I2+6Cl- | |
| D. | 将672mLCl2(标况)通入250mL 0.1molL-1的FeI2溶液中:2Fe2++10I-+6Cl2═12Cl-+5I2+2Fe3+ |
查看答案和解析>>
科目: 来源: 题型:解答题
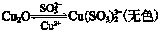
| 操作 | 现象 |
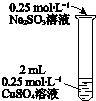 | i 有黄色沉淀出现,随着 Na2SO3溶液的滴入,沉淀增加,当加到5mL时,溶液的蓝色消失. ii 将试管加热,黄色沉淀变为砖红色,有刺激性气味气体产生. iii在加热条件下,继续滴入Na2SO3溶液,砖红色沉淀减少,当1加到10mL时,沉淀完全溶解,得无色溶液. |
查看答案和解析>>
科目: 来源: 题型:解答题
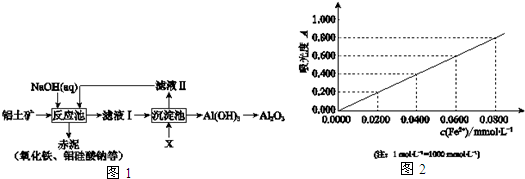
查看答案和解析>>
科目: 来源: 题型:解答题
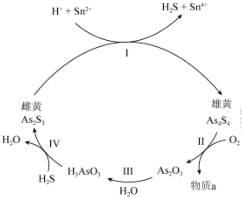
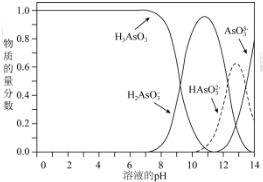
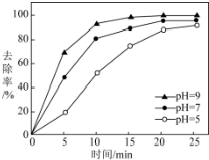
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 需要加热才能发生的反应,一定是吸收能量的反应 | |
| B. | 在化学反应过程中总是伴随着能量的变化 | |
| C. | 释放能量的反应在常温下一定很容易发生 | |
| D. | 在确定的化学反应中反应物的总能量总是高于生成物的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com