
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
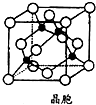 铁、铜均为日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁、铜均为日常生活中常见的金属,有着广泛的用途.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向反应后的溶液加入乙醇,溶液没有发生变化 | |
| B. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ | |
| C. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 | |
| D. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用VSEPR理论预测BF3和NF3的立体构型均为平面三角形 | |
| B. | CO2是直线形分子,其中碳原子的杂化轨道类型为sp3杂化 | |
| C. | 电子层结构相同的简单离子,其半径随核电荷数增大而减小 | |
| D. | 在化学反应中,某元素由化合态变为游离态,则该元素一定被还原 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 946kJ/mol | B. | 896kJ/mol | C. | 649kJ/mol | D. | 431kJ/mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 物质内部储存的能量--化学反应的热效应 | |
| B. | 分子间作用力的大小--分子稳定性的高低 | |
| C. | 原子核外电子排布--元素在周期表中的位置 | |
| D. | 有效碰撞几率的高低--化学反应速率的大小 |
查看答案和解析>>
科目: 来源: 题型:选择题
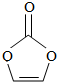
| A. | 分子式为C3H2O3 | B. | 分子中只含有极性键 | ||
| C. | 分子中含6个σ键 | D. | 各碳原子杂化的方式不同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 18g冰晶体中含有氢键的数目为2NA | |
| B. | 1molH2O2中含有非极性键的数目为NA | |
| C. | 1molSiO2晶体中含有Si-O键的数目为4NA | |
| D. | 22.4LHF(标准状况)中含有氟原子的数目为NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO2和SiO2都是直线形分子 | |
| B. | H2O和NH3的VSEPR模型不同 | |
| C. | 由分子构成的物质中一定含有共价键 | |
| D. | 形成共价键的元素不一定是非金属元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com