
科目: 来源: 题型:解答题
 某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验过程如下:
某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验过程如下:| 假设 | 实验操作 | 现象及结论 |
| 假设1:碳粉可用作还原剂,脱除硝酸盐 | 向烧杯中加入 碳粉一段时间后,测定烧杯中NO3-的浓度 | NO3-浓度无明显变化,说明假设不成立 |
| 假设2:碳粉、铁粉形成无数个微小的原电池,促进了硝酸盐的脱除 | 按下图所示组装实验装置,一段时间后,测定NO3-浓度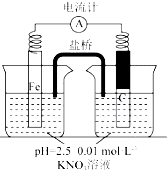 | Fe电极部分溶解,电流计指针偏转,说明假设2成立 |
查看答案和解析>>
科目: 来源: 题型:解答题
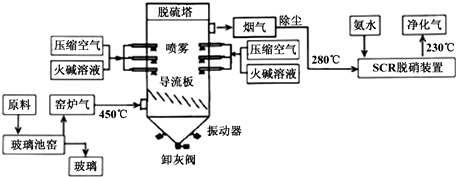
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | A的转化率增大 | ||
| C. | D的体积分数增大 | D. | a+b<c+d |
查看答案和解析>>
科目: 来源: 题型:填空题
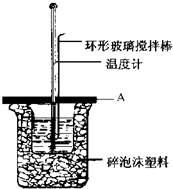 如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是减少热量损失; 若实验中不加盖泡沫塑料板,则求得的中和热数值(填偏大、偏小、无影响).
如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是减少热量损失; 若实验中不加盖泡沫塑料板,则求得的中和热数值(填偏大、偏小、无影响).查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO2的比例模型: | |
| B. | 氢氧根离子的电子式: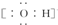 | |
| C. | 氯原子的结构示意图: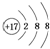 | |
| D. | 中子数为146、质子数为92的铀(U)原子:${\;}_{92}^{146}$U |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化学是以实验为基础的一门学科,定量研究方法是化学发展为一门独立学科的重要标志之一 | |
| B. | 燃煤脱硫、汽车中加装尾气处理装置、利用二氧化碳制造全降解塑料、推广新能源汽车都能有效减少环境污染 | |
| C. | 我国科学家屠呦呦发现的青蒿素(结构见图),其中有类似于H2O2的结构,因此遇到强还原性的物质会变质 | |
| D. | 利用氢氧化铁胶体的“丁达尔效应“,可以除去水中的悬浮颗粒,从而达到净水的效果 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 物质B的转化率增大 | B. | 平衡向正反应方向移动 | ||
| C. | 物质A的体积分数增大 | D. | a+b>m+n |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com