
科目: 来源: 题型:选择题
| A. | 为减少环境污染,常使用乙醇汽油代替化石燃料,乙醇可通过纤维素转化制得,是一种可再生的燃料 | |
| B. | 优良的催化剂可以降低反应温度,起到节能效果并提高反应物的转化率 | |
| C. | 分光光度计可用于分析溶液颜色与反应物(或生成物)浓度的关系,从而确定化学反应速率 | |
| D. | 某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、催化剂载体等 |
查看答案和解析>>
科目: 来源: 题型:解答题
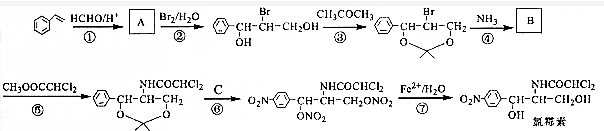
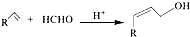
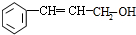 ;C的名称硝酸.
;C的名称硝酸.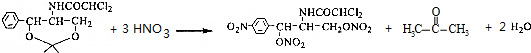 .
.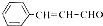 的合成路线.
的合成路线.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cl•在反应中是催化剂 | |
| B. | Cl•比Cl2更活泼 | |
| C. | ②也可能是Cl•(g)+CH4(g)→CH3Cl(g)+H•(g) | |
| D. | 由③可知C-Cl的键能比Cl-Cl的键能小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径大小为W>X>Z>Y | |
| B. | X、Y、Z的氢化物的水溶液均呈酸性 | |
| C. | W与Y形成的三原子化合物既含极性共价键又含非极性共价键 | |
| D. | Z元素的最高价氧化物对应的水化物酸性最强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使湿润的蓝色石蕊试纸变红的气体是氨气 | |
| B. | 瓷坩埚可用作Na2CO3与石英制Na2SiO3的反应容器 | |
| C. | 热Na2CO3溶液更利于清洗餐具上的油污 | |
| D. | 某溶液中加入BaCl2溶液,产生不溶于稀硝酸的沉淀,该溶液一定含有SO42- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用炭炽铁,炭是还原剂 | B. | 炽铁用炭,煤炭占17% | ||
| C. | 火墨燃烧温度比煤高 | D. | 炽铁不能用炊炭 |
查看答案和解析>>
科目: 来源: 题型:解答题

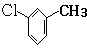 ,D分子中含氧官能团的名称为羧基,反应B→C的反应类型为取代反应.
,D分子中含氧官能团的名称为羧基,反应B→C的反应类型为取代反应.  ),下列有关G的叙述正确的是B.(填选项)
),下列有关G的叙述正确的是B.(填选项)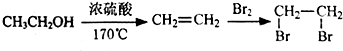
查看答案和解析>>
科目: 来源: 题型:解答题
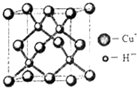 自然界中存在大量的金属元素,其 中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用.
自然界中存在大量的金属元素,其 中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用.| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
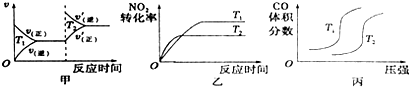
| 浓度/mol.L-1/时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
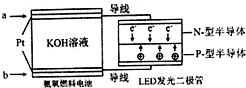
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com