
科目: 来源: 题型:选择题
| A. | 加入饱和Na2CO3溶液除去乙酸乙酯中混有的乙酸 | |
| B. | 分离苯和硝基苯的混合物,可用蒸馏法 | |
| C. | 除去苯中的杂质苯酚可加入浓溴水后过滤 | |
| D. | 从粗苯甲酸中提纯苯甲酸,可用重结晶法 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③④⑤⑦ | B. | ④⑤⑦ | C. | ④⑤ | D. | ①④⑤⑦ |
查看答案和解析>>
科目: 来源: 题型:选择题
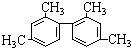 的烃的下列说法不正确的是( )
的烃的下列说法不正确的是( )| A. | 分子式为C16H18 | |
| B. | 分子中至少有11个碳原子处于同一平面上 | |
| C. | 属于苯的同系物 | |
| D. | 一氯代物存在5种同分异构体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 同系物:乙酸、软脂酸、硬脂酸 | B. | 同位素:氕、氘、氚 | ||
| C. | 同素异形体:金刚石、石墨、足球烯 | D. | 同分异构体:蔗糖、麦芽糖、葡萄糖 |
查看答案和解析>>
科目: 来源: 题型:解答题
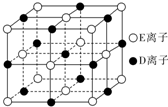 A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物对应的水化物酸性最强;F除最外层原子轨道处于半充满状态,其余能层均充满电子.G元素与D元素同主族,且相差3个周期.
A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物对应的水化物酸性最强;F除最外层原子轨道处于半充满状态,其余能层均充满电子.G元素与D元素同主族,且相差3个周期.查看答案和解析>>
科目: 来源: 题型:解答题
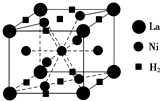 能源、材料和信息是现代社会的三大“支柱”.
能源、材料和信息是现代社会的三大“支柱”.查看答案和解析>>
科目: 来源: 题型:解答题
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 在元素周期表的各元素中电负性仅小于氟. |
| M | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 第四周期过渡元素,其价电子层各能级处于半充满状态 |
查看答案和解析>>
科目: 来源: 题型:解答题
 水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.
水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com