
科目: 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 氢氧化钠溶液可以除去尾气NO2 | NO2是酸性氧化物,可与碱液反应 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| C | 用浸有酸性高锰酸钾溶液的硅土作水果保鲜剂 | 高锰酸钾能还原水果释放的催熟剂乙烯 |
| D | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl | K2CO3与NH4Cl反应会生成氨气降低肥效 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
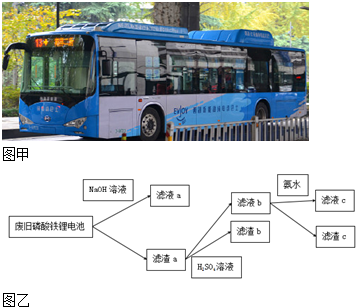
| A. | 向滤液a中加入适量H2SO4溶液,可以得到白色沉淀 | |
| B. | 滤液b中加入氨水的目的是使Fe3+沉淀,滤渣c为红褐色 | |
| C. | 要将Li从溶液中析出,可在滤液c中加入足量Na2CO3溶液,加热浓缩,冷却结晶 | |
| D. | 图中的氨水可以用适量NaOH溶液代替 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
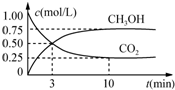 在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )| A. | 该化学反应在3 min时达到平衡状态 | |
| B. | 保持其他条件不变,降低温度,平衡时c(CH3OH)=0.85 mol•L-1,则该反应的△H<0 | |
| C. | 相同温度下,起始时向上述容器中充入0.5 mol CO2、1.5 mol H2,平衡时CO2的转化率小于75% | |
| D. | 12 min时,向上述容器中再充入0.25 mol CO2、0.25 mol H2O(g),此时反应将向逆反应方向进行 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | 在0.1 mol•L-1 NaHS溶液中:c(H+)=c(S2-)+c(OH-)+c(HS-) | |
| C. | 将0.1 mol•L-1 Na2CO3溶液和0.2 mol•L-1 NaHCO3溶液等体积混合:3c(Na+)=4c(CO32-)+4c(HCO3-) | |
| D. | 向0.1 mol•L-1 NaHSO4溶液中滴加氨水至溶液恰好呈中性:c(Na+)=c(NH4+)=c(SO42-)>c(OH-)=c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3.1 g由白磷和红磷组成的混合物中含有磷原子的数目为0.1NA | |
| B. | 0.1 mol丙烯醛中含有双键的数目为0.1 NA | |
| C. | 标准状况下,2.24 L乙醇中含有分子的数目为0.1NA | |
| D. | 0.1 mol的氯气全部溶于水后转移电子的数目为0.1NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 澄清透明的溶液中:Na+、K+、MnO4-、NO3- | |
| B. | pH=13的溶液中:Na+、K+、SO42-、HCO3- | |
| C. | 0.1 mol•L-1 NaClO溶液中:K+、Na+、NO3-、I- | |
| D. | 0.1 mol•L-1 FeCl3溶液中:Na+、NH4+、SCN-、SO42- |
查看答案和解析>>
科目: 来源: 题型:解答题
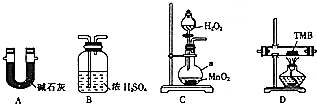 由碳、氢、氮三种元素组成的TMB是一种新型指纹检测的色原试剂,其相对分子质量为240.某研究性学习小组的同学欲利用下列装置测定TMB的分子式.实验原理:在足量氧气流中将4.80gTMB样品氧化(氮元素转化为N2),再利用吸收剂分别吸收水蒸气和CO2.请从图中选择适当的装置(部分装置可以重复)进行实验.
由碳、氢、氮三种元素组成的TMB是一种新型指纹检测的色原试剂,其相对分子质量为240.某研究性学习小组的同学欲利用下列装置测定TMB的分子式.实验原理:在足量氧气流中将4.80gTMB样品氧化(氮元素转化为N2),再利用吸收剂分别吸收水蒸气和CO2.请从图中选择适当的装置(部分装置可以重复)进行实验.查看答案和解析>>
科目: 来源: 题型:解答题
 化学中的某些元素与生命活动密不可分.请回答下列问题:
化学中的某些元素与生命活动密不可分.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
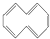 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 根据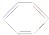 的结构特点可知环癸五烯的分子式为C10H8 的结构特点可知环癸五烯的分子式为C10H8 | |
| B. | 常温常压下环癸五烯是一种易溶于水的无色气体 | |
| C. | 环癸五烯既能使溴水褪色,又能使酸性KMnO4溶液褪色 | |
| D. | 环癸五烯与Cl2的加成产物只有一种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com