
科目: 来源: 题型:选择题
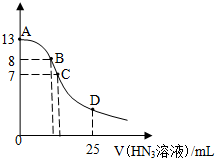 常温下向25mL0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1的HN3溶液(叠氮酸),pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10-4.7).下列说法正确的是( )
常温下向25mL0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1的HN3溶液(叠氮酸),pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10-4.7).下列说法正确的是( )| A. | A点水电离出的c(H+)小于B点 | |
| B. | 在B点,离子浓度大小为 c(OH-)>c(H+)>c(Na+)>c(N3-) | |
| C. | 在C点,滴加的V(HN3)=12.5mL | |
| D. | 在D点,c(H+)≈10-4.7 |
查看答案和解析>>
科目: 来源: 题型:解答题
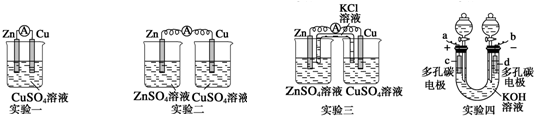
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在由水电离产生的氢离子浓度为10-13 mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3-四种离子能大量共存 | |
| B. | 已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.82×10-6 | |
| C. | 对于反应2N2H4(l)=N2(g)+2H2(g),△H=-50.6 kJ?mol-1,它只在高温下自发进行 | |
| D. | 常温下,将0.2 mol?L-1某一元碱(ROH)溶液和0.1 mol?L-1HCl溶液等体积混合,混合后溶液pH<7,则c(ROH)>c(R+) |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
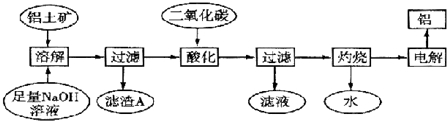
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在地壳中,B元素的含量位于第二位 | |
| B. | C元素的单质熔点低,在空气中加热时先熔化后燃烧 | |
| C. | A、B、D三种元素形成的化合物一定是强酸 | |
| D. | B元素与A元素形成的物质一定是纯净物 |
查看答案和解析>>
科目: 来源: 题型:解答题
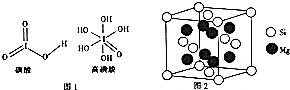 世界卫生组织(WHO)确认人体中的14种必需微量元素中有铜、铬、硅、碘、氟等.
世界卫生组织(WHO)确认人体中的14种必需微量元素中有铜、铬、硅、碘、氟等.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X3Y2 | B. | X2Y | C. | X2Y5 | D. | XY3 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 序号 | 主要实验步骤及实验现象 |
| ① | 在含Y的溶液中,加入稀硫酸放置,产生浅黄色沉淀和无色有刺激性气味的气体,该气体可使品红溶液褪色 |
| ② | 在含Z的溶液中,滴加盐酸,开始有白色沉淀,继续滴加盐酸,白色沉淀先增加后消失,然后加入过量的氨水又出现白色沉淀 |
| ③ | 将实验②最终得到的混合物加热蒸发、灼烧,最终得到白色固体 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/℃ | 600 | 700 |
| 平衡常数 | K1 | K2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com