
科目: 来源: 题型:选择题
| A. | 常温下,1 mol•L-1甲酸溶液的pH值约为2 | |
| B. | 甲酸电离出的阳离子全部是H+ | |
| C. | 10mL1 mol•L-1甲酸与10 mL1 mol•L-1NaOH溶液完全反应后,溶液呈碱性 | |
| D. | 1LH+浓度为0.1 mol•L-1的甲酸和足量Zn反应放出的H2在标况下远大于1.12L |
查看答案和解析>>
科目: 来源: 题型:解答题
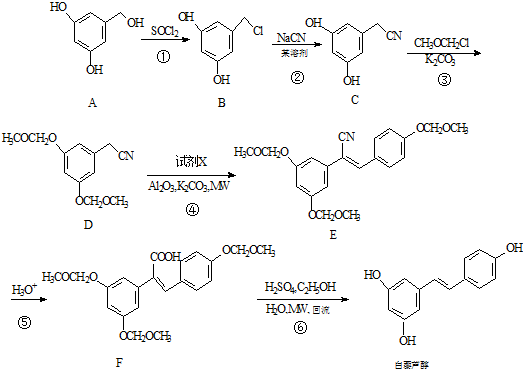
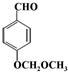 .
.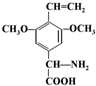 或
或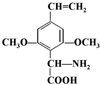 .(任写一种)
.(任写一种)查看答案和解析>>
科目: 来源: 题型:解答题
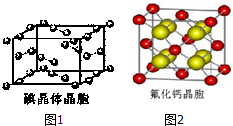 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)查看答案和解析>>
科目: 来源: 题型:解答题
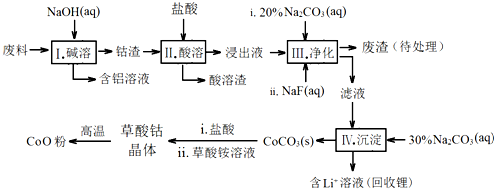
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol二甲醚中含有的C-O键的数目为2NA | |
| B. | 标准状况下,44.8LHF中含有分子的数目为2NA | |
| C. | 200g质量分数为23%的HCOOH水溶液中含氧原子的总数目为2NA | |
| D. | 在反应Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2中,每生成1molCu,转移电子的数目为2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 对“地沟油”进行分馏可得到汽油 | |
| B. | PM2.5、CO2都属于空气质量日报的内容 | |
| C. | 硅酸多孔、吸水能力强,常用作袋装食品的干燥 | |
| D. | 向煤中加入适量CaSO4,可大大减少燃烧产物中SO2的量 |
查看答案和解析>>
科目: 来源: 题型:解答题
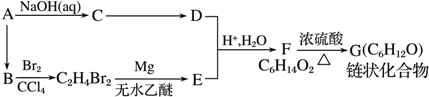
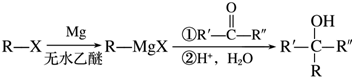 (R表示烃基,R′和R″表示烃基或氢)
(R表示烃基,R′和R″表示烃基或氢)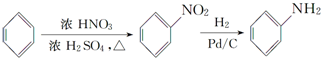
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com