
科目: 来源: 题型:解答题
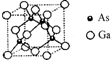 砷化镓晶体是半导体材料,应用于太阳能电池、LED光源和通讯领域.
砷化镓晶体是半导体材料,应用于太阳能电池、LED光源和通讯领域.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
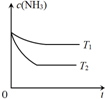 氨是一种重要的化工产品.
氨是一种重要的化工产品.| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
查看答案和解析>>
科目: 来源: 题型:选择题
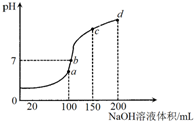 室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:对图中a、b、c、d四个点分析中,正确的是( )
室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:对图中a、b、c、d四个点分析中,正确的是( )| A. | a点水的电离程度最大 | B. | b点c(NH4+)=2c(SO42-) | ||
| C. | c点c(NH4+)+c(NH3•H2O)=c(Na+) | D. | d点c(NH4+)+c(Na+)=c(SO42-)+c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Y元素最高价氧化物对应的水化物化学式为H2YO3 | |
| B. | 元素Y和W的非金属性强弱比较:Y<W | |
| C. | 原子半径由小到大的顺序为:Y<X<W<Z | |
| D. | X、Z两种元素的氧化物中所含化学键类型相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电池工作时,电子由正极通过外电路流向负极 | |
| B. | 该电池反应中二氧化锰作正极,发生氧化反应 | |
| C. | 该电池工作时,电解液中的K+向锌极定向移动 | |
| D. | 电池负极的反应式为:Zn(s)-2e-+2OH-(aq)=Zn(OH)2(s) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1molCu与足量的S反应转移电子数为2NA | |
| B. | 46g有机物C2H6O中含有共价键的数目为7NA | |
| C. | 在0.5L2mol•L-1的Na2CO3溶液中含CO32-的数目为NA | |
| D. | 10gD2O和H218O的混合物中含有的中子数为5NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 福尔马林可浸制标本,利用了其使蛋白质变性的性质 | |
| B. | 歼-20飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| C. | 将地沟油制成肥皂,可以提高资源的利用率 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现碳的循环利用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com