
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 升高温度 | |
| B. | 恒温恒容再充入a mol CO和2a mol H2 | |
| C. | 恒温恒容再充入H2 | |
| D. | 充入Ar(g)使体系的总压增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 冰镇的啤酒打开后泛起泡沫 | |
| B. | 对N2+3H2?2NH3的反应,使用铁触媒可加快合成氨反应的速率 | |
| C. | 工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| D. | 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 工业上现在大规模采用电解熔融NaCl或AlCl3制取Na或Al | |
| B. | 若电工操作中将铝线与铜线直接相连,会导致铜线更快被氧化 | |
| C. | 某反应的平衡常数K300℃>K350℃,则该反应△H<0 | |
| D. | 合成氨生产中将NH3液化分离,目的是加快正反应速率,提高H2的转化率 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 采用碳捕集和储存技术,逐步实现二氧化碳的零排放 | |
| B. | 扩大铅蓄电池、汞锌锰等含重金属元素的干电池的生产,满足消费需求 | |
| C. | 对工业废水、生活污水净化处理,减少污染物的排放 | |
| D. | 催化处理汽车尾气,减轻氮氧化物污染和光化学烟雾 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氧化剂与还原剂的物质的量之比是2:1 | |
| B. | 当生成22.4LSO2气体时,转移的电子数目是2NA | |
| C. | 该反应写成离子式是Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$Cu+SO2↑+2H2O | |
| D. | 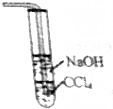 制备SO2装置尾气可用如图处理 |
查看答案和解析>>
科目: 来源: 题型:解答题
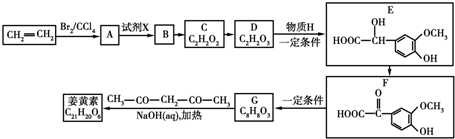


 .
.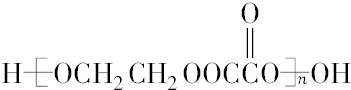 .
.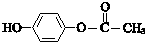 .
.查看答案和解析>>
科目: 来源: 题型:解答题
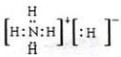 ;
;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 福尔马林可作食品的保鲜剂 | |
| B. | 用CO2合成聚碳酸酯可降解塑料,实现碳的循环利用 | |
| C. | “天宫一号”使用的碳纤维,是一种新型有机高分子材料 | |
| D. | 制作快餐饭盒的可降解“玉米塑料”(主要成分是聚乳酸)是纯净物 |
查看答案和解析>>
科目: 来源: 题型:解答题
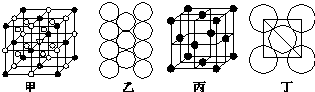
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com