
科目: 来源: 题型:填空题
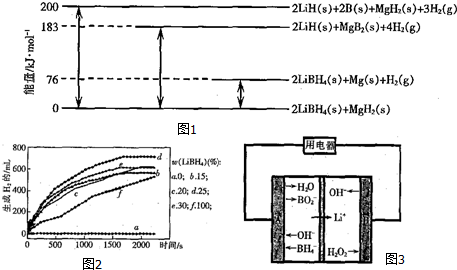
查看答案和解析>>
科目: 来源: 题型:填空题
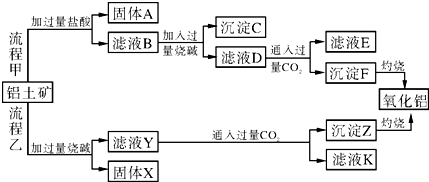
查看答案和解析>>
科目: 来源: 题型:解答题
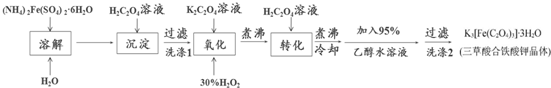
查看答案和解析>>
科目: 来源: 题型:解答题
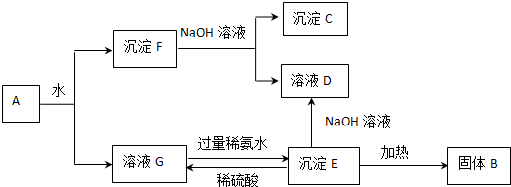
查看答案和解析>>
科目: 来源: 题型:选择题
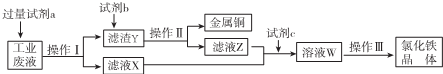
| A. | 试剂a是铁、试剂b是稀硫酸 | |
| B. | 试剂c是氯气,相应的反应为:2Fe2++Cl2═2Cl-+2Fe3+ | |
| C. | 操作I、操作Ⅱ、操作Ⅲ所用仪器相同 | |
| D. | 直接蒸干W溶液得到的氯化铁固体不含有结晶水 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CaCl2和Na2O2 | B. | NaOH和CCl4 | C. | CO2和MgCl2 | D. | NaOH和NaClO |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 44g14C1802所含有的中子数为28NA | |
| B. | 32gCH4中所含共价键数为8NA | |
| C. | 7.8gNa2O2固体中所含离子数为0.4NA | |
| D. | 17gOH-所含有的电子数为9NA |
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com