
科目: 来源: 题型:填空题
| 序号 | 物质 | 被选出的 |
| (1) | O2、H2、C、N2 | C |
| (2) | Fe、Na、Al、Si | Si |
| (3) | NO、CO2、SO2、Fe3O4 | Fe3O4 |
查看答案和解析>>
科目: 来源: 题型:解答题
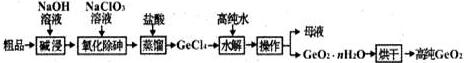
查看答案和解析>>
科目: 来源: 题型:解答题
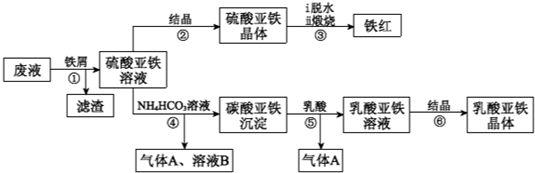
查看答案和解析>>
科目: 来源: 题型:解答题
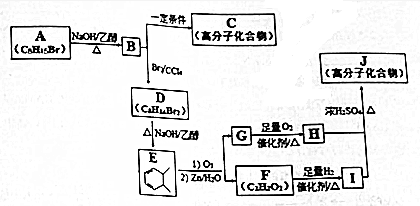
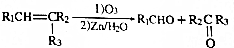
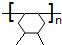 .
.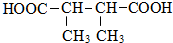 +n HOCH2CH2OH$→_{△}^{浓硫酸}$
+n HOCH2CH2OH$→_{△}^{浓硫酸}$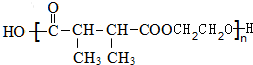 +(2n-1)H2O.
+(2n-1)H2O.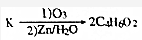 ,则K的同分异构体可能有7种(不考虑立体异构),写出其中一种的结构简式
,则K的同分异构体可能有7种(不考虑立体异构),写出其中一种的结构简式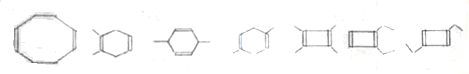 任意一种.
任意一种.查看答案和解析>>
科目: 来源: 题型:选择题
| 键能 | 键能 | 键能 | |||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 |
| S=S | 255 | H-S | 339 | C-F | 427 |
| C-Cl | 330 | C-I | 218 | H-F | 565 |
| C-O | 347 | H-O | 464 |
| A. | 键能越大,物质的热稳定性越强 | |
| B. | 热化学方程式H2(g)+Cl2(g)═2HCl(g);△H=-QkJ•mol-1中,Q的值为185 | |
| C. | H-O键的键能大于H-S键的键能,所以H2O的溶沸点高于H2S的溶沸点 | |
| D. | C-Br键的键能应在218kJ•mol-1-330kJ•mol-1之间 |
查看答案和解析>>
科目: 来源: 题型:多选题
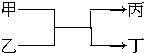 若甲、丙均为短周期,不同主族元素组成的单质,乙、丁都是氧化物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )
若甲、丙均为短周期,不同主族元素组成的单质,乙、丁都是氧化物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )| A. | 碳和镁 | B. | 氟气和氧气 | C. | 碳和氢气 | D. | 氧气和硫 |
查看答案和解析>>
科目: 来源: 题型:选择题
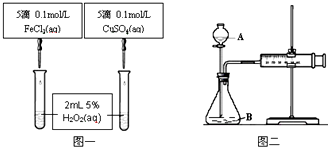
| A. | 图一可通过观察实验现象定量比较反应速率的大小 | |
| B. | 将CuSO4改为CuCl2更为合理 | |
| C. | 无法检查图二装置的气密性 | |
| D. | 图二所示实验中只需测量的数据是气体体积 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,4.4gCO2和N2O混合物中所含有的原子数为0.3NA | |
| B. | 标准状况下2.24L己烷分子中含有1.9NA对共用电子 | |
| C. | 0.1molFe与0.1mol氯气反应时失去的电子数为0.3NA | |
| D. | 电解精炼铜时,阳极质量每减少32g,电路中就转移NA个电子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 茂密树林中的道道光柱,既谁一种自然现象又是光学现象,与胶体知识无关 | |
| B. | 焰火的五彩缤纷是某些金属元素化学性质的展现 | |
| C. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮的氧化物无关 | |
| D. | CO2合成聚碳酸酯可降解塑料,以实现“碳”的循环利用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com