
科目: 来源: 题型:解答题
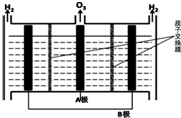 NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,根据题意回答下列问题:
NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,根据题意回答下列问题:| 时间(s) | 0 | 1 | 2 | 3 | 4 | … |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.00×10-4 | 1.70×10-4 | 1.00×10-4 | 1.00×10-4 | … |
查看答案和解析>>
科目: 来源: 题型:解答题
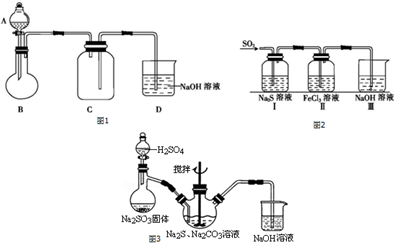
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含有NH4+、Cl-、H+、OH-的溶液中,离子浓度是c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | pH=5的NH4Cl溶液与pH=5的硫酸中,水电离的c(H+)相同 | |
| C. | pH=9的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 将0.2 mol•L-1 CH3COOH溶液和0.1 mol•L-1NaOH溶液等体积混合,则反应后的混合溶液中:2c(OH-)+c(CH3COO-)=2c(H+)+c(CH3COOH) |
查看答案和解析>>
科目: 来源: 题型:解答题
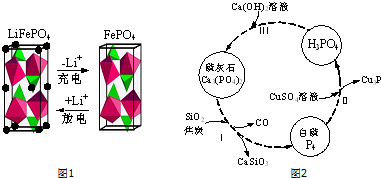
查看答案和解析>>
科目: 来源: 题型:解答题
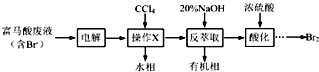

查看答案和解析>>
科目: 来源: 题型:解答题
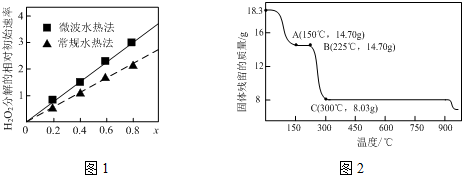
查看答案和解析>>
科目: 来源: 题型:解答题
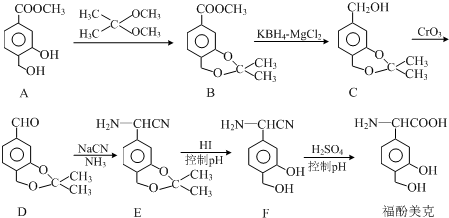
 .
.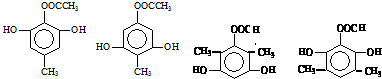 任意一种.
任意一种.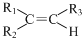 $→_{②Zn/H_{20}}^{①O_{3}}$
$→_{②Zn/H_{20}}^{①O_{3}}$ 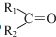 +R3CHO,根据已有知识并结合相关信息,写出以
+R3CHO,根据已有知识并结合相关信息,写出以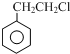 为原料制备
为原料制备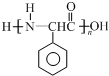 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).查看答案和解析>>
科目: 来源: 题型:解答题
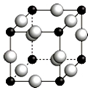 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):查看答案和解析>>
科目: 来源: 题型:多选题
| A. | N2O结构式可表示为N=N=O | |
| B. | O3分子呈直线形 | |
| C. | CH2=CH-CHO分子中碳原子均采用sp2杂化 | |
| D. | 相同压强下,HCOOH沸点比CH3OCH3高,说明前者是极性分子,后者是非极性分子 |
查看答案和解析>>
科目: 来源: 题型:解答题

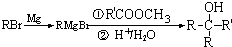 ②
②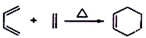
 .
.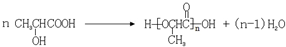 .
.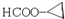 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com