
科目: 来源: 题型:解答题
 氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注.
氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2%H2O2溶液 | 无 |
| ② | 10mL 5%H2O2溶液 | 无 |
| ③ | 10mL 5%H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5%H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | S2-的结构示意图: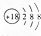 | |
| B. | 质子数为38,中子数为50的Sr原子:5038Sr | |
| C. | NH4Cl的电子式: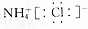 | |
| D. | PBr3的结构式: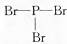 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
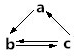 下列所列各组物质中,物质之间通过一部步反应不能实现如图所示转化的是( )
下列所列各组物质中,物质之间通过一部步反应不能实现如图所示转化的是( ) | 选项 | a | b | c |
| A | Al2O3 | Na[Al(OH)4] | Al(OH)3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | Fe | FeCl3 | FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
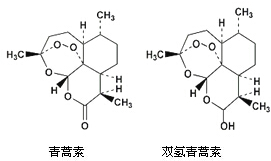 中国女药学家屠呦呦因创新性抗疟药青蒿素和双氢青蒿素而获得诺贝尔生理学或医学奖.颁奖理由是“因为发现青蒿素-一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.下列关于青蒿素和双氢青蒿素(结构如图)说法错误的是( )
中国女药学家屠呦呦因创新性抗疟药青蒿素和双氢青蒿素而获得诺贝尔生理学或医学奖.颁奖理由是“因为发现青蒿素-一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.下列关于青蒿素和双氢青蒿素(结构如图)说法错误的是( )| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 由青蒿素制备双氢青蒿素的反应属还原反应 | |
| C. | 青蒿素和双氢青蒿素均能跟氢氧化钠反应 | |
| D. | 青蒿素分子中含有过氧键和酯基、醚键 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3.2g | B. | 6.4g | C. | 9.6g | D. | 12.8g |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 共得到0.96g硫 | B. | 通入H2S的体积为336mL | ||
| C. | 硫元素先被还原后被氧化 | D. | 转移电子总数为3.0×10-2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com