
科目: 来源: 题型:选择题
| A. | 氮气的电子式: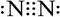 | B. | 镁离子的结构示意图: | ||
| C. | 中子数为16的磷原子:${\;}_{16}^{31}$P | D. | 丙烯的结构简式:CH3CHCH2 |
查看答案和解析>>
科目: 来源: 题型:选择题
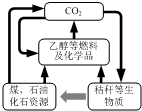 我国《可再生能源法》倡导碳资源的高效转化及循环利用(如图所示).下列做法与上述理念相违背的是( )
我国《可再生能源法》倡导碳资源的高效转化及循环利用(如图所示).下列做法与上述理念相违背的是( )| A. | 大力发展煤的气化及液化技术 | B. | 加快石油等化石燃料的开采和使用 | ||
| C. | 以CO2 为原料生产可降解塑料 | D. | 将秸秆进行加工转化为乙醇燃料 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 序号 | 操作及现象 | 结 论 |
| A | 将0.1mol•L-1 Na2CO3溶液稀释到0.01mol•L-1,测得pH变小 | 稀释后CO32-的水解程度减小 |
| B | 向某无色溶液中滴加盐酸酸化的BaCl2溶液,产生白色沉淀 | 原溶液中一定含有SO42- |
| C | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 向溴水中加入少量苯,振荡静置后水层为无色 | 苯与Br2发生了加成反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
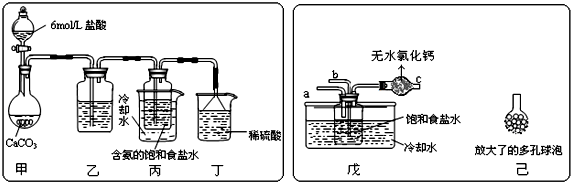
查看答案和解析>>
科目: 来源: 题型:解答题
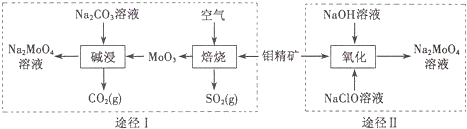
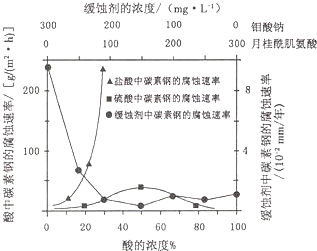
 .
.
查看答案和解析>>
科目: 来源: 题型:填空题
物理量 实验序号 | 0.1mol?L-1Fe2(SO4)3 的体积/mL | 30% H2O2 的体积/mL | H2O 的体积/mL |
| 1 | 0.5 | 15 | 24.5mL |
| 2 | 0.5 | 30 | 9.5 |
 N2O4(g),也是放热反应,升温使平衡向左移动,C(NO2)增大,颜色加深.
N2O4(g),也是放热反应,升温使平衡向左移动,C(NO2)增大,颜色加深.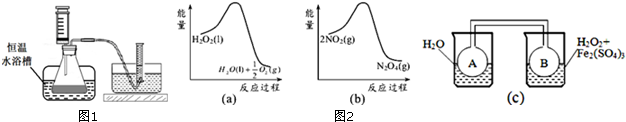
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
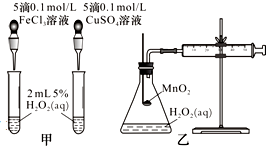 影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究.| 序号 | 温度/℃ | 催化剂 | 现象 | 结论 |
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该实验得到的NaCl中无其他任何杂质 | |
| B. | 检验所得NaCl中是否混有BaCl2,可用AgNO3溶液检验 | |
| C. | 该实验基本操作分为溶解、过滤和蒸发三个步骤 | |
| D. | 除去杂质时,不必考虑所加试剂的顺序 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验变量 实验序号 | 银氨溶液的量/mL | |||
| 1 | ||||
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com