
科目: 来源: 题型:选择题
| A. | X>Y>Z | B. | Y>X>Z | C. | Y>Z>X | D. | Z>Y>X |
查看答案和解析>>
科目: 来源: 题型:解答题
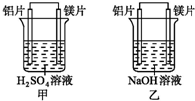 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6mol•L-1 H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6mol•L-1 H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.查看答案和解析>>
科目: 来源: 题型:解答题

 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ①②③④⑥ | C. | ①②③⑤ | D. | ②④⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 合成顺丁橡胶(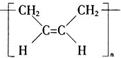 )的单体是CH2=CH-CH=CH2 )的单体是CH2=CH-CH=CH2 | |
| B. | 甲醇、乙二醇、丙三醇都为饱和醇,熔沸点依次递增 | |
| C. | 1mol 绿原酸  通过消去反应脱去1 molH2O时,能得到6 种不同产物(不考虑立体异构) 通过消去反应脱去1 molH2O时,能得到6 种不同产物(不考虑立体异构) | |
| D. | 0.1 mol的 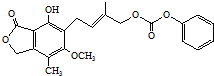 最多能与含0.5 molNaOH的水溶液完全反应 最多能与含0.5 molNaOH的水溶液完全反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
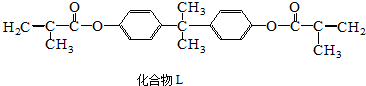
| A. | 1mol L分别与足量NaOH溶液和H2反应,最多可消耗4molNaOH和10molH2 | |
| B. | 有机酸M与油酸互为同系物,双酚A与苯酚互为同系物 | |
| C. | 与M含相同官能团的同分异构体还有2种 | |
| D. | 等物质的量的L、A和M 与足量浓溴水发生反应,消耗Br2的量之比为1:2:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
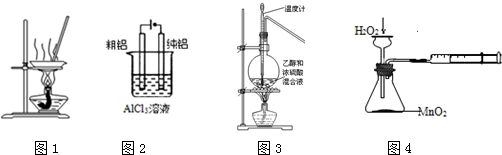
| A. | 用图1装置蒸发FeCl3溶液制备无水FeCl3 | |
| B. | 用图2装置电解精炼铝 | |
| C. | 用图3装置乙醇脱水制乙烯 | |
| D. | 用图4装置定量测定化学反应速率 |
查看答案和解析>>
科目: 来源: 题型:解答题
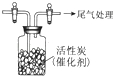 某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.
某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO2的电子式: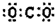 | |
| B. | 基态Fe原子的外围电子排布图为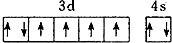 | |
| C. | 在基态多电子原子中,P轨道电子能量一定高于s轨道电子能量 | |
| D. | 根据原子核外电子排布的特点,Cu在元素周期表中位于s区 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com