
科目: 来源: 题型:选择题
| A. | HOCH2CH2CHO | |
| B. | 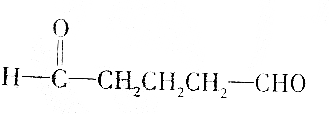 | |
| C. | 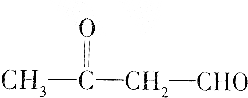 | |
| D. | 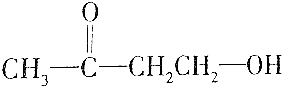 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH3-CH=CH-CHO | B. | CH3-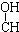 - -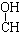 -CH3 -CH3 | ||
| C. | HOCH2-CH2-CH=CH-CHO | D. | HOCH2-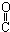 -CH2-CHO -CH2-CHO |
查看答案和解析>>
科目: 来源: 题型:选择题
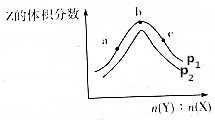 一定温度下,某密闭容器中存在反应:X(g)+2Y(g)?2Z(g),测得平衡体系中Z的体积分数与体系的压强(p)、投料比[b(Y):n(X)]关系如图所示,下列分析一定正确的是( )
一定温度下,某密闭容器中存在反应:X(g)+2Y(g)?2Z(g),测得平衡体系中Z的体积分数与体系的压强(p)、投料比[b(Y):n(X)]关系如图所示,下列分析一定正确的是( )| A. | p2>p1 | B. | Y的转化率:a<c<b | ||
| C. | b点时n(Y):n(X)=2 | D. | 该反应是一个放热反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
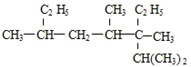 2,3,4,6-四甲基-3-乙基辛烷
2,3,4,6-四甲基-3-乙基辛烷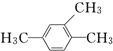 1,2,4-三甲苯
1,2,4-三甲苯查看答案和解析>>
科目: 来源: 题型:解答题
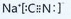 .
.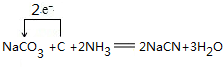 .
.
查看答案和解析>>
科目: 来源: 题型:解答题
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 6.2×10-10 |
| HClO | 3×10-8 |
| NH3•H2O | 1.8×10-5 |
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1.1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 9.1×10-6 |
| CaCO3 | 2.8×10-9 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
| SO2 | O2 | SO3 | Ar | ||
| 甲 | 4 | 2 | 0 | 0 | 放出热量:Q1 |
| 乙 | 3 | 1.5 | 1 | 0 | 放出热量:Q2 |
| 丙 | 3 | 1.5 | 1 | 0.1 | 放出热量:Q3 |
| A. | Q1=Q2=Q3=394 kJ | |
| B. | 若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1<-197 kJ•mol-1 | |
| C. | 甲、乙、丙3个容器中反应的平衡常数不相等 | |
| D. | 达到平衡时,丙容器中SO2的体积分数最大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 250mL | B. | 200 mL | C. | 100 mL | D. | 不能确定 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该反应中氧化剂与氧化产物的物质的量之比为4:1 | |
| B. | 生成3.2g S同时放出4.48LNO2 | |
| C. | AgI的悬浊液中滴加Na2S溶液可转化成黑色沉淀 | |
| D. | 若将产物NO2收集于密闭容器里再置于热水中,气体颜色变浅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com