
科目: 来源: 题型:选择题
| A. | 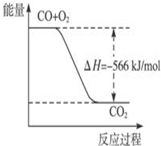 图可表示由CO生成CO2的反应过程和能量关系 | |
| B. | CO的燃烧热为566 kJ/mol | |
| C. | Na2O2(s)+CO2(s)=Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226 kJ/mol | |
| D. | CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2×6.02×1023 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CuCl2[CuSO4] | B. | NaCl[HCl] | C. | NaOH[Na2O] | D. | CuSO4[Cu(OH)2] |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| B. | 氢气的燃烧热为285.5 kJ•mol-1,则水分解的热化学方程式2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| C. | 已知稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,则浓硫酸与稀NaOH溶液反应生成1 mol水时放出的热量为57.3 kJ | |
| D. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)=FeS(s)△H=-95.6 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电解池的反应属于自发过程 | |
| B. | 化学反应热效应数值与参加反应的物质多少有关 | |
| C. | 化学反应过程中的能量变化除了热能外,也可以是光能、电能等 | |
| D. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 |
查看答案和解析>>
科目: 来源: 题型:选择题
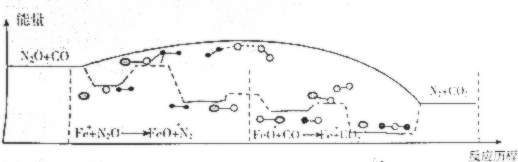
| A. | N2O与CO反应的△H<0 | |
| B. | FeO+也是该反应的催化剂 | |
| C. | Fe+使该反应的活化能减小 | |
| D. | Fe++N2O→FeO++N2、FeO++CO→Fe++CO2两步反应均为放热反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
 氮及其化合物与人类生产、生活息息相关.回答下列问题:
氮及其化合物与人类生产、生活息息相关.回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1molS2C12价电子数为66NA | |
| B. | 氧化产物与还原产物的物质的量之比为l:7 | |
| C. | 每生成l mol SO2转移4 NA电子 | |
| D. | 每生成48g硫单质会断裂5NA共价键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 操 作 | 现象 | 结论 |
| A | 实验1:4mL 0.01mol/L KMnO4酸性溶液+2mL 0.1mol/LH2C2O4溶液+4mL水; 实验2:4mL 0.01mol/L KMnO4酸性溶液+4mL 0.1mol/L H2C2O4溶液+2mL水; 记录褪色时间. | 实验2先褪色 | H2C2O4浓度越大反应速率越快. |
| B | 用洁净铂丝蘸取无色溶液进行焰色反应 | 火焰呈黄色 | 无色溶液为钠盐溶液 |
| C | 向砖红色Ag2CrO4沉淀上滴加 0.1mol/LNaCl溶液 | 沉淀变为黑色 | Ksp(Ag2CrO4)>Ksp(AgCl) |
| D | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸未发生反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com