
科目: 来源: 题型:选择题
| A. | 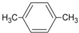 的名称:1,4-二甲苯 的名称:1,4-二甲苯 | B. | 丙烷的分子式:CH3CH2CH3 | ||
| C. | 聚丙烯的链节:-CH2-CH2-CH2- | D. | H2S的电子式: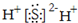 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子内电子数多于中子数 | B. | 与${\;}_{117}^{296}$Uus电子式相同 | ||
| C. | 元素的近似相对原子质量是294 | D. | 处于不完全周期内 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 中性溶液中可能大量存在Fe3+、K+、Cl-、SO42- | |
| B. | 标准状况下,将1.12 L CO2气体通入1 L 0.1 mol/L的NaAlO2溶液中:CO2+2H2O+AlO2-═Al(OH)3↓+HCO3- | |
| C. | 由水电离出的c(H+)=1×10-12 mol/L 的溶液中可能大量存在K+、I-、Mg2+、NO3- | |
| D. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═NH3•H2O+Al(OH)3↓+2BaSO4↓ |
查看答案和解析>>
科目: 来源: 题型:解答题
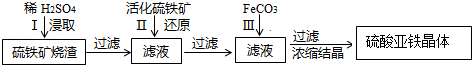
| pH | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 5.8 | 8.8 |
| Fe(OH)3 | 1.1 | 3.2 |
| Al(OH)3 | 3.0 | 5.0 |
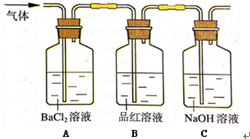 .
.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 6mol | B. | 4.7mol | C. | 3mol | D. | 2.4mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若二者恰好中和,则一定是 a=b | B. | 若混合液显碱性,则一定是 b≥a | ||
| C. | 若混合液显中性,则一定是 a≤b | D. | 若混合液显酸性,则一定是 a>b |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 为测定新制氯水的pH值,用玻璃棒蘸取待测液滴在pH试纸上,与比色卡对照即可 | |
| B. | 做蒸馏实验时,如果在液体沸腾前发现忘记加沸石,应立即停止加热,冷却后补加沸石 | |
| C. | 在未知液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知液中存在SO32-、SO42- | |
| D. | 提纯混有少量硝酸钾的氯化钠,采用在较高的温度下制成浓溶液再冷却结晶、过滤、干燥的方法 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 二氧化碳通入溶液后,先生成KHCO3 | |
| B. | 此白色固体可能为KOH 和K2CO3 | |
| C. | 原KOH溶液中物质的量浓度一定是0.500mol/L | |
| D. | 此白色固体可能有两种组成情况,这两种混合物都有含有K2CO3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④ | B. | ①③④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目: 来源: 题型:选择题
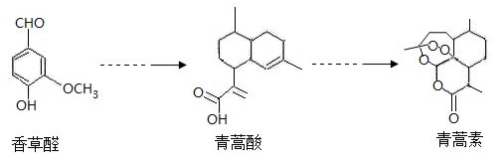
| A. | 青蒿素能发生水解反应 | |
| B. | 青蒿素易溶于乙醚 | |
| C. | 在一定条件下,香草醛可与HCHO发生缩聚反应 | |
| D. | 可用FeCl3 溶液或 NaHCO3溶液鉴别香草醛和青蒿酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com