
科目: 来源: 题型:选择题
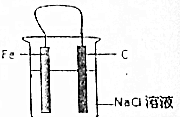 有关Fe-C-Nac1溶液构成的原电池中,叙述错误的是( )
有关Fe-C-Nac1溶液构成的原电池中,叙述错误的是( )| A. | 铁片为负极,碳棒为正极 | |
| B. | 铁被腐蚀,碳棒上有氯气放出 | |
| C. | 碳棒附近的溶液可使酚酞变红 | |
| D. | 导线上有电流通过,电流方向是由碳极流向铁极 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 苯主要是从石油分馏中获得的一种重要化工原料 | |
| B. | 甲烷和苯都能使酸性高锰酸钾溶液褪色 | |
| C. | 石油和煤均属于化石燃料,所含元素种类不相同 | |
| D. | C3H8有两种同分异构体,C5H12有三种同分异构体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 反应物 | 反应条件1 | 反应条件2 | |
| A | CH3CHICH3 | NaOH的水溶液,加热 | NaOH的乙醇溶液,加热 |
| B | 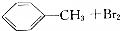 | 光照 | 铁粉 |
| C | 乙醇+氧 | 点燃 | Cu做催化剂,加热 |
| D | 乙烯 | 溴水 | 溴的四氯化碳溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应后生成NO的体积为28 L | B. | 所得溶液中c(Fe2+):c(Fe3+)=1:1 | ||
| C. | 所得溶液中c(NO3-)=2.75 mol/L | D. | 所得溶液中的溶质只有FeSO4 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | Fe3+ | B. | HS- | C. | 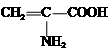 | D. | C6H5O- |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
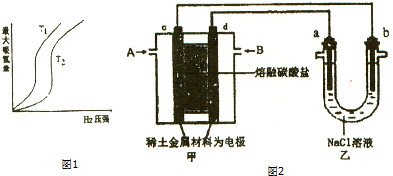
查看答案和解析>>
科目: 来源: 题型:解答题
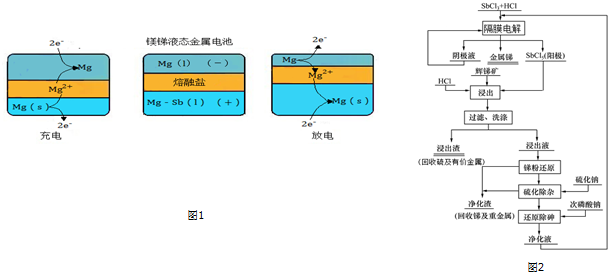
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com