
科目: 来源: 题型:解答题
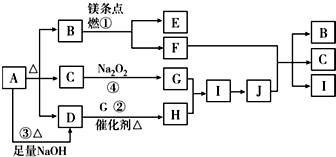
查看答案和解析>>
科目: 来源: 题型:选择题
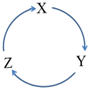 下列各物质中,不能按如图(“→”表示一步完成)关系相互转化的是( )
下列各物质中,不能按如图(“→”表示一步完成)关系相互转化的是( )| 选项 | X | Y | Z |
| A | Fe | FeCl3 | FeCl2 |
| B | Cl2 | NaClO | NaCl |
| C | Si | SiO2 | H2SiO3 |
| D | HNO3 | NO | NO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若a=b,pH(NaX)>pH(NaY),则相同浓度时,酸性HX>HY | |
| B. | 若a=b,并测得溶液中c(X-)=c(Y-)+c(HY)(c(HY)≠0),则相同浓度时,酸性HX>HY | |
| C. | 若a>b,并测得溶液中c(HX)=c(HY),则可推出溶液中c(X-)>c(Y-),且相同浓度时,酸性HX>HY | |
| D. | 若两溶液等体积混合,测得溶液中c(X-)+c(Y-)+c(HX)+c(HY)=0.1 mol/L,则可推出a+b=0.2 mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 当混合气体的平均摩尔质量不再发生变化时,说明反应达到平衡状态 | |
| B. | 用X表示5 min内此反应的反应速率是(0.1-0.2a)mol•(L•min)-1 | |
| C. | 向平衡后的体系中加入l mol M,v(逆)增大,v(正)减小,平衡逆向移动 | |
| D. | 若平衡后再充入l mol X和(n+1)mol Y,再次达平衡时X的物质的量大于(2-2a)mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
| A. | 反应在0~t1 min内的平均速率为v(SO3)=0.088/t1 mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.10 mol SO3和0.010 mol O2,到达平衡时,n(SO2)=0.012 mol | |
| C. | 保持其他条件不变,升高温度,平衡时c(SO2)=0.007 0 mol•L-1,则反应的△H>0 | |
| D. | 相同温度下,起始时向容器中充入0.050 mol SO2和0.030 mol O2,达到平衡时SO2转化率大于88% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 石油的分馏和煤的干馏都属于物理变化 | |
| B. | 通过对95%的酒精直接蒸馏获得无水酒精 | |
| C. | 在石油的分馏、实验室制乙烯以及制备硝基苯的三个实验中,温度计水银球的位置分别位于蒸馏烧瓶支管口、反应液液面以下、水浴中 | |
| D. | 用C8H18萃取溴水中的溴,可观察到溶液分层,下层为橙红色,上层接近无色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 一定温度下,反应MgCl2(1)═Mg(1)+Cl2(g)的△H<0,△S>0 | |
| B. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为△H=2×(-57.3)kJ/mol | |
| C. | 铜分别与浓HNO3、稀HNO3反应,还原产物分别为NO2、NO,所以浓HNO3氧化性小于稀HNO3 | |
| D. | 对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com