
科目: 来源: 题型:解答题
| 化学键 | C-C | C-H | Si-Si | Si-H |
| 键能(KJ/mol) | 356 | 413 | 226 | 318 |
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
查看答案和解析>>
科目: 来源: 题型:多选题
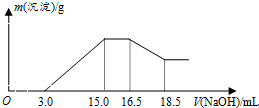
| A. | 铝与混合溶液反应的离子方程式为8Al+30H++3NO3-→8Al3++3NH4++9H2O | |
| B. | 参加反应硝酸根离子物质的量为0.06mol | |
| C. | 参加反应的铝与镁的质量之比为4:3 | |
| D. | 混合液中硫酸的物质的量的浓度为0.36mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | HNO3、Ba(NO3)2、NH4NO3、AgNO3 | B. | HNO3、NH4NO3、Ba(NO3)2、AgNO3 | ||
| C. | NH4NO3、HNO3、Ba(NO3)2、AgNO3 | D. | NH4NO3、HNO3、AgNO3、Ba(NO3)2 |
查看答案和解析>>
科目: 来源: 题型:解答题
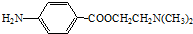 )可用作临床麻醉剂,熔点约60℃.它的一条合成路线如下图所示(部分反应试剂和条件已省略):
)可用作临床麻醉剂,熔点约60℃.它的一条合成路线如下图所示(部分反应试剂和条件已省略):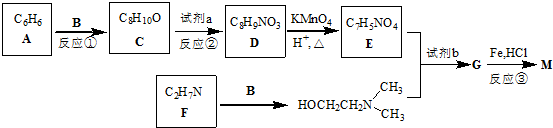
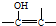 的结构不稳定.
的结构不稳定.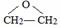 FH3C-NH-CH3
FH3C-NH-CH3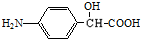 .
.查看答案和解析>>
科目: 来源: 题型:解答题
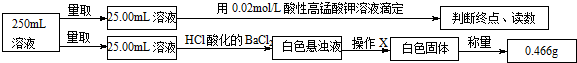
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 10.32 | 10.02 | 9.98 |
查看答案和解析>>
科目: 来源: 题型:解答题

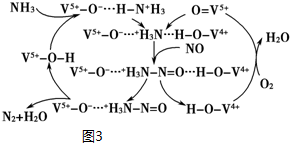
查看答案和解析>>
科目: 来源: 题型:多选题
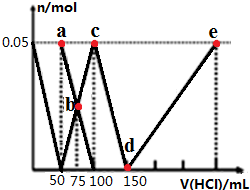
| A. | 原混合溶液中的n(CO32-):n(AlO2-)=1:1 | |
| B. | a点溶液中:c(HCO3-)+c(H2CO3)+c(H+)=c(OH-) | |
| C. | b点溶液中浓度顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-) | |
| D. | d→e的过程中水的电离程度逐渐减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
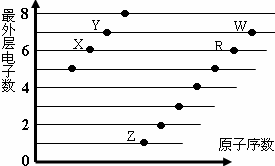
| A. | 元素非金属性:X>R>W | |
| B. | X与R形成的分子内含两种作用力 | |
| C. | X、Z形成的化合物中可能含有共价键 | |
| D. | 元素对应的离子半径:W>R>X |
查看答案和解析>>
科目: 来源: 题型:解答题
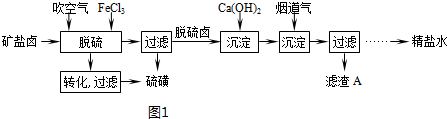
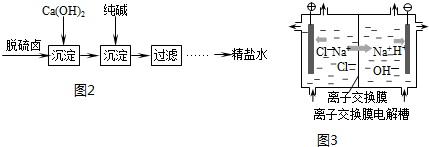
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com