
科目: 来源: 题型:选择题
| A. | 四种元素的原子半径大小为Z>Y>X>W | |
| B. | 元素W与氢形成的原子比为1:1的化合物只有2种 | |
| C. | X、Y、Z的最高价氧化物对应的水化物能相互反应 | |
| D. | 由Y与Z组成的化合物在熔融时能导电 |
查看答案和解析>>
科目: 来源: 题型:解答题
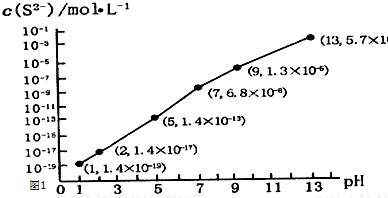
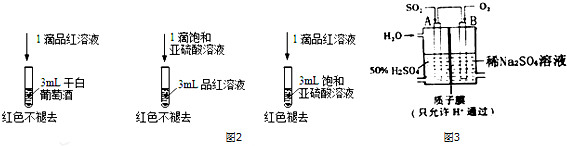
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 检验蔗糖是否水解:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察现象 | |
| B. | 检验溶液中是否含有NH4+:取少量待检验溶液,向其中加入浓NaOH溶液加热,再用湿润的红色石蕊试纸放置试管口,观察现象 | |
| C. | 提纯含有少量苯酚的苯:向含有少量苯酚的苯加入过量浓溴水,振荡后静置过滤,除去三溴苯酚沉淀 | |
| D. | 探究化学反应的限度:取5mL0.1mol/LKI溶液,滴加0.1mol/LFeCl3溶液5~6滴,充分反应,可根据溶液中即含I2又含I-的实验事实判断该反应是可逆反应 |
查看答案和解析>>
科目: 来源: 题型:多选题
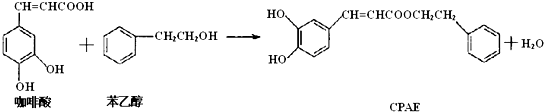
| A. | 咖啡酸分子中所有原子不可能处在同一个平面上 | |
| B. | 可用金属Na检测上述反应是否残留苯乙醇 | |
| C. | 1mol 苯乙醇在O2中完全燃烧,需消耗10molO2 | |
| D. | 1mol CPAE与足量的NaOH溶液反应,最多消耗3molNaOH |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | B极中填充多孔的炭或石墨毡,目的是为了增加导电性 | |
| B. | 电池放电时,A极电极反应为:2Na++xS+2 e-=Na2SX | |
| C. | 电池放电时,Na+向电极A极移动 | |
| D. | 电池放电的总反应为2Na+xS=Na2SX,每消耗1molNa转移2mol电子 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 稀释浓硫酸时把水沿着烧杯内壁缓慢注入浓硫酸中,并用玻璃棒搅拌 | |
| B. | 称量2.0gNaOH固体时先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 | |
| C. | 用装置甲除去乙烯中少量SO2气体 | |
| D. | 用装置乙分液,从分液漏斗下口放出有机相,关闭活塞再从分液漏斗上口倒出水相 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- | |
| B. | 水电离的c(H+)=10-12 mol•L-1的溶液:K+、Ba2+、NH4+、Br- | |
| C. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1 mol•L-1的溶液:Na+、K+、SiO32-、NO3- | |
| D. | 1.0 mol•L-1的CaCl2溶液:Na+、K+、Cl-、CO32- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:W>Z>Y | |
| B. | 元素Y的简单气态氢化物的热稳定性比W的弱 | |
| C. | 元素W最高价氧化物的水化物为强酸 | |
| D. | 化合物从X2Y、Z2Y中化学键的类型相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 元素H的单质存在H2、D2、T2三种同素异形体 | |
| B. | 在该反应条件下,H2的还原性强于Fe的还原性 | |
| C. | 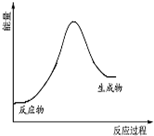 该反应的能量变化关系可以用如图表示 | |
| D. | 1molFe与水蒸气完全反应转移的电子数为3×6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com