
科目: 来源: 题型:选择题
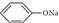 ⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是( )
⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是( )| A. | ③①④②⑥⑤ | B. | ①③⑥④②⑤ | C. | ③②①⑥④⑤ | D. | ⑤⑥②④①③ |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验 | pH | 现象 |
| A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
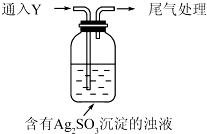
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
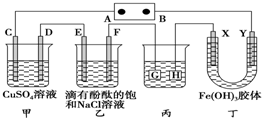
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| A | |||||||||||||||||
| D | E | I | |||||||||||||||
| B | C | F | H | G | |||||||||||||
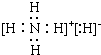 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②③④⑥ | B. | ①⑤⑥ | C. | ②③④ | D. | ①⑤⑦ |
查看答案和解析>>
科目: 来源: 题型:解答题
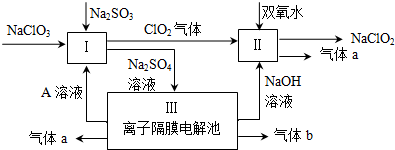
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1molC3H6Cl2中化学键总数为NA | |
| B. | 14g乙烯和丙烯混合气体中含原子数为3NA | |
| C. | 标准状况下,1L苯完全燃烧生成的气态产物的分子数为$\frac{6}{22.4}$NA | |
| D. | 0.1NA乙醇分子完全燃烧所消耗的氧气为0.3mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com